题目内容
【题目】脱除工业尾气中的二氧化硫气体对物质的充分利用和环境保护有重要意义。
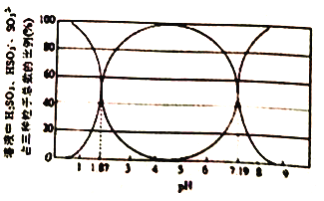
(1)某温度下,二氧化硫溶于水后所得溶液中H2SO3、HSO3-和SO32-占三种粒子总数的比例随pH 的变化如图所示。则在pH 为3时,溶液中H2SO3、HSO3-和SO32-的浓度最大的为_____。该温度下H2SO3 的电离平衡常数Ka1=_________。
(2)利用尿素[CO(NH2)2]水解的溶液可以吸收空气中含有的SO2。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O![]() H2NCOONH4 (氨基甲酸铵)。
H2NCOONH4 (氨基甲酸铵)。
①当该反应处于平衡状态时,下列措施中有利于提高尿素水解程度的是____(填字母)。
a.升高反应温度 b.延长反应时间
c.增大尿素的浓度 d.向装置中充入SO2和空气混合物
②氨基甲酸铵会与空气中的SO2和O2反应:2 H2NCOONH4 (aq)+2SO2(g)+2O2(g)+H2O![]() 2(NH4)2SO4(aq )+2CO2(g),判断该反应达到平衡状态的标志是_______(填字母)。
2(NH4)2SO4(aq )+2CO2(g),判断该反应达到平衡状态的标志是_______(填字母)。
a.SO2和CO2浓度相等 b. SO2百分含量保持不变
c.容器中气体的压强不变 d.CO2的生成速率与SO2的消耗速率相等
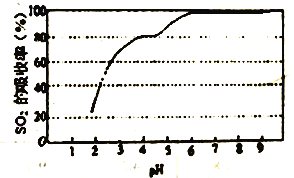
③尿素溶液吸收SO2的吸收率随溶液的pH变化如图所示。尿素溶液吸收空气中的SO2后溶液的pH 会降低,为提高SO2 的吸收率和充分回收产物,应控制溶液pH 为_____。
(3)工业上也常用氨水吸收SO2 。25℃时将SO2通入氨水中,当产物恰好为NH4HSO3时,溶液为_____ (填酸性、中性或碱性)。当c(OH-)降至1.0×10-7mol/L时,溶液中的c(SO32-)/c(HSO3-)=__________。己知25℃,NH3·H2O 的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。
【答案】 HSO3- 10-1.87 d bc 6 酸性 0.62
【解析】(1)二氧化硫溶于水,与水反应生成亚硫酸,亚硫酸以一级电离为主,随着溶液pH的增大,c(H2SO3)逐渐减小,c(HSO3-)逐渐增大,到一定程度后c(HSO3-)达到最大,随后将逐渐减小,c(SO32-)逐渐增大,根据图像,pH为3时,浓度最大的是HSO3-,在pH为1.87时,c(H2SO3)=c(HSO3-),该温度下H2SO3的电离平衡常数Ka1=![]() = c(H+)=10-1.87,故答案为:HSO3-;10-1.87;
= c(H+)=10-1.87,故答案为:HSO3-;10-1.87;
(2)①a.升高反应温度,平衡逆向移动,不利于提高尿素水解程度,错误;b.延长反应时间,平衡不移动,不能提高尿素水解程度,错误;c.增大尿素的浓度,平衡正向移动,但尿素水解程度减小,错误;d.向装置中充入SO2和空气混合物,H2NCOONH4浓度减小,平衡正向移动,有利于提高尿素水解程度,正确;故选d;
②a.平衡时SO2和CO2浓度不一定相等,错误;b. SO2百分含量保持不变,说明达到了化学平衡状态,正确;c.反应恰好气体的物质的量发生变化,当容器中气体的压强不变,说明达到了化学平衡状态,正确;d.CO2的生成速率与SO2的消耗速率相等都是正反应速率,不能判断是否达到了平衡状态,错误;故选bc;
③根据图像,在pH=6左右时,SO2的吸收率达到了很高的程度,应控制溶液pH为6,故答案为:6;
(3) 25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。NH4+的水解常数=![]() =
=![]() ×10-9,HSO3-的电离常数=6.2×10-8,因此以HSO3-的电离为主,溶液显酸性;当c(OH-)降至1.0×10-7mol/L时,溶液中的
×10-9,HSO3-的电离常数=6.2×10-8,因此以HSO3-的电离为主,溶液显酸性;当c(OH-)降至1.0×10-7mol/L时,溶液中的![]() =
=![]() =
=![]() =
=![]() =0.62,故答案为:酸性;0.62。
=0.62,故答案为:酸性;0.62。