题目内容
【题目】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g)![]() CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5 kJ/mol、285.5 kJ/mol、283.0 k J/mol,则x=____;为提高合成甲醇反应的选择性,关键因素是__________________________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应,相关数据如图一。
①该化学反应0~10 min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是_____(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为______。
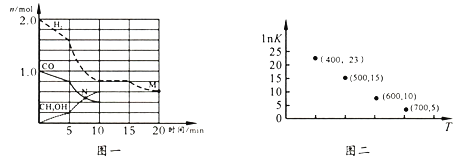
③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是________________。
(3)干燥的甲醇可用于制造燃料电池。
①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为______________________________;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为___________________________。
【答案】 -127.5 kJ/mol 催化剂(或提高催化剂的选择性) 0.12 mol/(L·min) 不能确定 2/9(或22.22%) ![]() atm-2 该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小 CH3OH+ NaOH
atm-2 该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小 CH3OH+ NaOH ![]() HCOONa+ 2H2 ↑ 2CO32--4e-==2CO2↑+O2↑
HCOONa+ 2H2 ↑ 2CO32--4e-==2CO2↑+O2↑
【解析】(1)已知常温下CH3OH、H2和CO的燃烧热分别为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则有①CH3OH(l)+O2(g)= CO2(g)+2H2O(l) △H1=-726.5kJ/mol,②H2(g)+ ![]() O2(g)= H2O(l) △H2=-285.5kJ/mol,③CO(g)+
O2(g)= H2O(l) △H2=-285.5kJ/mol,③CO(g)+ ![]() O2(g)= CO2(g) △H3=-283.0kJ/mol, 根据盖斯定律,由③+②×2-①得反应CO(g)+2H2(g)
O2(g)= CO2(g) △H3=-283.0kJ/mol, 根据盖斯定律,由③+②×2-①得反应CO(g)+2H2(g)![]() CH3OH(l)△H=-283.0kJ/mol+(-285.5kJ/mol)×2-(-726.5kJ/mol)= -127.5kJ/mol,即x= -127.5kJ/mol;为提高合成甲醇反应的选择性,关键因素是催化剂或提高催化剂的选择性;(2)①该化学反应0~10min的平均速率v(H2)=
CH3OH(l)△H=-283.0kJ/mol+(-285.5kJ/mol)×2-(-726.5kJ/mol)= -127.5kJ/mol,即x= -127.5kJ/mol;为提高合成甲醇反应的选择性,关键因素是催化剂或提高催化剂的选择性;(2)①该化学反应0~10min的平均速率v(H2)=  =0.12mol/(L·min);N点改变的条件未知,无法确定浓度变化是增大还是减小,M和N点的逆反应速率大小不能确定;②10min时容器内CH3OH、H2和CO的物质的量浓度分别为0.6mol/L、0.4mol/L、0.8mol/L,故CO的体积分数为
=0.12mol/(L·min);N点改变的条件未知,无法确定浓度变化是增大还是减小,M和N点的逆反应速率大小不能确定;②10min时容器内CH3OH、H2和CO的物质的量浓度分别为0.6mol/L、0.4mol/L、0.8mol/L,故CO的体积分数为![]() ;③温度不变,平衡常数不变,故TK下10min时,反应达平衡时CH3OH、H2和CO的物质的量浓度分别为0.6mol/L、0.4mol/L、0.8mol/L,体积分数分别为
;③温度不变,平衡常数不变,故TK下10min时,反应达平衡时CH3OH、H2和CO的物质的量浓度分别为0.6mol/L、0.4mol/L、0.8mol/L,体积分数分别为![]() 、
、![]() 、
、![]() ,KP=
,KP=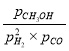 =
=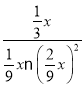 atm-2;实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图二,请分析1nK随T呈现上述变化趋势的原因是该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小;(3) ①利用NaOH干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为CH3OH+NaOH
atm-2;实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图二,请分析1nK随T呈现上述变化趋势的原因是该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小;(3) ①利用NaOH干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为CH3OH+NaOH ![]() HCOONa+2H2↑;②阳极CO32-失电子产生氧气,电极反应式为2CO32--4e-==2CO2↑+O2↑。
HCOONa+2H2↑;②阳极CO32-失电子产生氧气,电极反应式为2CO32--4e-==2CO2↑+O2↑。