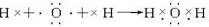题目内容
回答下列问题:(1)有一种溶液除H+、OH-外,还有Na+、![]() 和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.003 5 mol·L-1和0.004 mol·L-1,该溶液的pH为__________。
和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.003 5 mol·L-1和0.004 mol·L-1,该溶液的pH为__________。
(2)NH4Cl溶液显酸性,试用离子方程式表示这一反应:___________________________。
(3)液氨类似于水的电离,试写出液氨的电离方程式:______________________________;在液氨中加入NH4Cl,则平衡将向____________移动。
(4)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来的体积的m倍和n倍,稀释后两溶液的pH仍相同,则m____________n(选填“>”“<”或“=”);若改用pH相同的盐酸和硫酸溶液,进行上述操作,则m____________n(选填“>”“<”或“=”)。
(1)3
(2)H2O+![]()
![]() NH3·H3O+H+
NH3·H3O+H+
(3)2NH3![]()
![]() +
+![]() 逆向移动
逆向移动
(4)> =
解析:(1)由电荷守恒知:c(H+)+c(Na+)=c(OH-)+![]() )+c(Cl-)
)+c(Cl-)
c(H+)-c(OH-)=2×0.035 mol·L-1+0.004 mol·L-1-0.01 mol·L-1
c(H+)-c(OH-)=0.001 mol·L-1
c(H+)>>c(OH-)
c(H+)≈0.001 mol·L-1 pH=3
(2)NH4Cl(aq)呈酸性,因为![]() 发生了水解,即
发生了水解,即![]() +H2O
+H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
(3)水的电离为:H2O+H2O![]()
![]() +OH-,因为液氨的电离与水电离相似,所以应为2NH3
+OH-,因为液氨的电离与水电离相似,所以应为2NH3![]()
![]() +
+![]() 。在其中加入NH4Cl,由于c(
。在其中加入NH4Cl,由于c(![]() )增加,而使平衡逆向移动。
)增加,而使平衡逆向移动。
(4)由于NH3·H2O是弱碱,加水稀释,可促进其电离正向进行,所以pH相同的NH3·H2O和NaOH溶液,稀释相同的倍数后,NH3·H2O的pH大于NaOH的pH,若要稀释后pH相同,则应满足m大于n。
由于盐酸、硫酸均为强酸,在溶液中全部电离,所以pH相同的两种酸若稀释相同的倍数,则其pH仍相同,故需满足m=n。