题目内容
【题目】乙基叔丁基酸(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂,用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)![]() ETBE(g) ΔH。回答下列问题:
ETBE(g) ΔH。回答下列问题:

(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如上图所示,该反应的ΔH=______akJ·mol-1,下列选项正确的是______(填序号)。
A.反应历程的最优途径是C1
B.HZSM-5没有参加化学反应
C.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
D.升高反应温度有利于提高平衡产率
(2)向刚性容器中按物质的量之比1:1充入乙醇和异丁烯,在温度为378K与388K时异丁烯的转化率随时间变化如图所示。

①图中A、M、B三点,化学反应速率由大到小的顺序为__________________,其中逆反应速率最大的点是_________(用符号A、M、B填写)。
②388K时,容器内起始总压为P0 Pa,用分压表示的该反应的平衡常数Kp=____________Pa-1(用含有P0的式子表示)。
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为:k=A![]() (其中,k为速率常数A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是_________(填序号,k正、k逆为正、逆速率常数)。
(其中,k为速率常数A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是_________(填序号,k正、k逆为正、逆速率常数)。
A.其他条件不变,升高温度,k正增大,k逆变小
B.其他条件不变,使用催化剂,k正、k逆同倍数增大
C.其他条件不变,増大反应物浓度k正增大,k逆不变
D.其他条件不变,减小压强,k正、k逆都变小
已知反应速率![]() ,计算上图中M点
,计算上图中M点 =_________(保留两位小数)
=_________(保留两位小数)
【答案】-4 A M>B>A A ![]() B 5.33
B 5.33
【解析】
(1)焓变等于生成物总能量减去反应物总能量;根据改变反应速率的影响因素分析。
(2)①温度升高,反应速率增大,缩短平衡所需时间,并根据反应速率与温度、浓度关系进行分析;
②建立三段式进行计算;
③根据影响化学反应速率的因素分析与k正、k逆的关系;先计算![]() ,再计算M点的各物质的关系与总压强,再根据公式进行计算。
,再计算M点的各物质的关系与总压强,再根据公式进行计算。
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如上图所示,该反应的ΔH=(1-5)a kJ·mol1=-4a kJ·mol1;
A.根据图中信息,过渡态1的活化能是4a kJ·mol1,过渡态2的活化能是6a kJ·mol1,过渡态3的活化能是6a kJ·mol1,因此反应历程的最优途径是C1,故A正确;
B.HZSM-5参加化学反应,降低反应的活化能,能够使化学反应速率大大加快,故B错误;
C.相同条件下,采用不同途径时,由于不能改变反应物、生成物的总能量,因此乙醇的平衡转化率相等,故C错误;
D.该反应是放热反应,升高反应温度,平衡逆向移动,因此不利于提高平衡产率,故D错误;
综上所述,答案为:-4;A。
(2)①温度升高,反应速率增大,缩短平衡所需时间,因此L1为388K时异丁烯的转化率,M、A是388K温度下的反应,反应正向进行,M点的浓度比A点浓度大,反应速率快,所以反应速率是M>A,M、B点浓度相同,B点温度低,因此反应速率M>B,A、B观察斜率,反应速率B>A,故化学反应速率由大到小的顺序为M>B>A,A、M、B三点中A点温度高于B点,A点生成物的浓度大于M、B点,所以图中A、M、B三点,逆反应速率最大的点是A点,故答案为:M>B>A;A。
②388K时,假设加入的物质的量都为amol,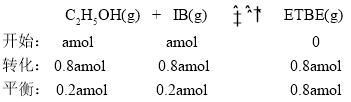 ,容器内起始总压为P0 Pa,根据压强之比等于物质的量之比
,容器内起始总压为P0 Pa,根据压强之比等于物质的量之比![]() ,P=0.6P0 Pa,用分压表示的该反应的平衡常数
,P=0.6P0 Pa,用分压表示的该反应的平衡常数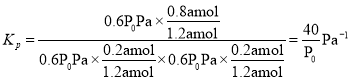 ;故答案为:
;故答案为:![]() 。
。
③A.其他条件不变,升高温度,正逆反应速率增大,因此k正增大,k逆增大,故A错误;B.其他条件不变,使用催化剂,催化剂同等程度的改变反应速率,因此k正、k逆同倍数增大,故B正确;C.反应速率常数只与反应温度有关,其他条件不变,増大反应物浓度,k正不变,k逆不变,故C错误;D.反应速率常数只与反应温度有关,其他条件不变,减小压强,k正、k逆都不变,故D错误;已知反应速率![]() ,当反应达到平衡时,
,当反应达到平衡时,![]() ,则
,则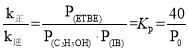 ,假设开始时n(异丁烯)= n(乙醇)=amol,M点转化率为60%,因此M点时n(异丁烯)= n(乙醇)=0.4amol,n(ETBE)=0.6amol,气体总物质的量为0.4amol + 0.4amol+0.6amol =1.4amol,此时压强
,假设开始时n(异丁烯)= n(乙醇)=amol,M点转化率为60%,因此M点时n(异丁烯)= n(乙醇)=0.4amol,n(ETBE)=0.6amol,气体总物质的量为0.4amol + 0.4amol+0.6amol =1.4amol,此时压强![]() ,M点
,M点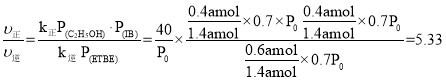 ;故答案为:B;5.33。
;故答案为:B;5.33。

【题目】CH3COOH、H2CO3、H2SO3的电离常数如表所示。
酸 | 电离常数 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
请回答下列问题:
(1)①NaHSO3溶液中电荷守恒表达式_____。
②NaHSO3溶液中各离子浓度大小顺序:_____。
(2)①用离子方程式表示Na2CO3溶液碱性的原因_____。
②写出Na2CO3溶液中物料守恒表达式______。
③写出NaHCO3溶液中质子守恒表达式______。
(3)常温下,物质的量浓度相同的下列溶液:
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④NH4HSO4 ⑤(NH4)2Fe(SO4)2
溶液中c(NH4+)从大到小排列顺序为____(填序号)。
(4)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为____(填序号)。
(5)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):____,将AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是____(填化学式)。
(6)证明CH3COOH是弱电解质的简单且可行的方法是:_____。
(7)下列混合溶液中,各离子浓度的大小顺序或等量关系正确的是____。
A.10 mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2 mol/LNaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
E.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO





