题目内容
【题目】前四周期元素X、Y、Z、M的原子序数依次增大。元素X和铝在元素周期表中具有特殊的“对角线”关系,单质及化合物的性质十分相似;Y原子半径在短周期主族元素中最大;Z元素有多种同素异形体,其中一种为正四面体结构,易自燃;M基态原子未成对电子数在同周期元素中最多。
请回答下列问题:
(1)元素Z在周期表中的位置是_______。
(2)元素X的氧化物能与Y的氧化物的水化物形成的溶液反应,生成一种四配位化合物,写出该化合物的化学式________。
(3)元素Y的氢化物被称作“万能还原剂”,具有强的还原性。其电子式为______,遇水可发生反应的化学方程式为________。
(4)元素M的名称为_______,其+3价氧化物与铝反应的化学方程式为_______。
【答案】第3周期第ⅤA族 Na2[Be(OH)4] ![]() NaH+H2O=NaOH+H2↑ 铬 2Al+Cr2O3
NaH+H2O=NaOH+H2↑ 铬 2Al+Cr2O3![]() 2Cr+Al2O3
2Cr+Al2O3
【解析】
前四周期元素X、Y、Z、M的原子序数依次增大。元素X和铝在元素周期表中具有特殊的“对角线”关系,单质及化合物的性质十分相似,则X是Be元素;Y原子半径在短周期主族元素中最大,则Y是Na元素;Z元素有多种同素异形体,其中一种为正四面体结构,易自燃,Z是P元素;M基态原子未成对电子数在同周期元素中最多,则M是Cr元素。据此分析解答。
根据上述分析可知X是Be元素,Y是Na元素,Z是P元素,M是Cr元素。
(1)元素Z是P,核外电子排布是2、8、5,所以P元素在周期表中的位置是第3周期第ⅤA族;
(2)元素X的氧化物是BeO,该氧化物能与Y的氧化物的水化物NaOH溶液反应,生成一种四配位化合物,根据Be单质及化合物的性质与Al单质及化合物的性质十分相似,结合Al元素的化合物Na[Al(OH)4],结合Be元素化合价为+2价,可知该化合物的化学式为Na2[Be(OH)4];
(3)Na元素的原子容易失去电子形成Na+,H元素的原子获得电子形成![]() ,二者通过离子键结合形成离子化合物NaH,电子式为
,二者通过离子键结合形成离子化合物NaH,电子式为![]() ;该物质遇水可发生反应产生NaOH和H2,反应的化学方程式为NaH+H2O=NaOH+H2↑;
;该物质遇水可发生反应产生NaOH和H2,反应的化学方程式为NaH+H2O=NaOH+H2↑;
(4)由于前四周期的M元素的未成对电子数最多,结合元素的原子序数可知元素M是Cr,元素的名称为铬,其+3价氧化物Cr2O3与铝在高温下发生铝热反应产生Al2O3和Cr,反应的化学方程式为2Al+Cr2O3![]() 2Cr+Al2O3。
2Cr+Al2O3。

 培优三好生系列答案
培优三好生系列答案【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) =2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
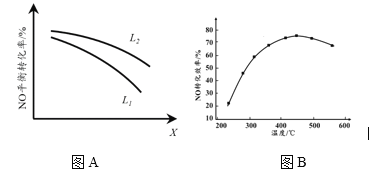
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系______,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大