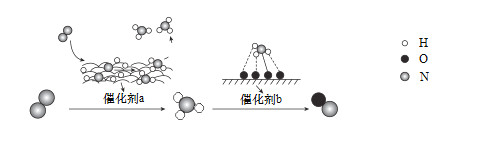
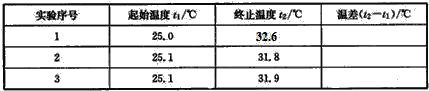
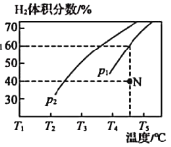
题目内容
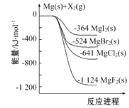
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结构如图所示。若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
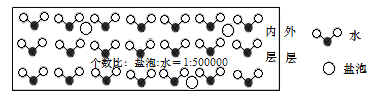
A.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
B.海冰内层“盐泡”越多,密度越小
C.海冰冰龄越长,内层的“盐泡”越少
D.若冰的密度为0.9g·cm﹣3,则海冰内层NaCl的浓度约为10-4mol·L﹣1
【答案】CD
【解析】
A.NaCl是离子化合物,不存在NaCl分子,A错误;
B.NaCl的式量大于H2O的相对分子质量,而且体积小,所以盐泡的密度比水大,海冰内层“盐泡”越多,密度越大,B错误;
C.根据题干信息,若海冰的冰龄达到1年以上,融化后的水为淡水,说明其中盐泡不再存在,因此海冰冰龄越长,内层的“盐泡”越少,C正确;
D.若冰的密度为0.9g·cm-3,则每1L冰的质量为900g,假设其中含有NaCl的物质的量是x,则海冰中含有H2O的物质的量是5×105xmol,58.5x+5×105xmol×18=900g,解得x=10-4mol,所以海冰内层NaCl的浓度约为10-4mol·L﹣1,D正确;
故合理选项是CD。

【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行