题目内容
【题目】(1)某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。
限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、MnSO4、蒸馏水、试管、量筒、秒表、恒温水浴槽。
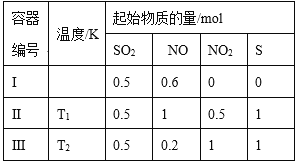
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
①写出上述反应的离子方程式:________________________。
②上述实验①②是探究____________对化学反应速率的影响;上述实验②④是探究____________对化学反应速率
影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为______________;表格中的“乙”填写t/s,其测量的是______________________。
③实验①中对“乙”重复测量三次,所得数值分别13.6,13.5,13.4。忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___________ 。
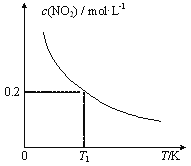
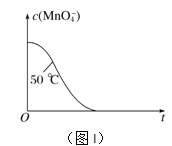
④已知实验①50℃时c(MnO![]() )~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO
)~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO![]() )~t的变化曲线示意图。______________
)~t的变化曲线示意图。______________
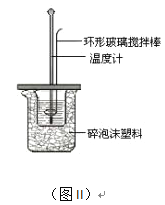
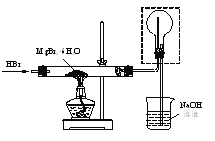
(2)测定中和热的实验装置如图II所示。
①写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式_______________________(中和热数值为57.3 kJ/mol):
②取60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.9 | |
2 | 26.2 | 26.4 | 26.3 | 30.6 | |
3 | 25.9 | 25.9 | 25.9 | 29.5 | |
4 | 26.4 | 26.2 | 26.3 | 30.0 | |
近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=________________________kJ/mol(列出计算式)。
③能引起中和热偏高的原因是(填字母)__________。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.用50mL0.50mol/L醋酸代替了硫酸进行反应,
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
E. 量取硫酸溶液的体积时仰视读数
【答案】 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 温度 催化剂 0.5 溶液褪色所需时间 5.0×10-4 mol·L-1·s-1 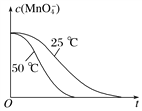 1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol 或H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l) △H=-114.6kJ/mol
1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol 或H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l) △H=-114.6kJ/mol 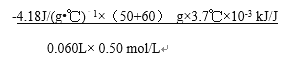 A
A
【解析】试题分析:(1)MnO4-被H2C2O4还原为Mn2+,H2C2O4被氧化为CO2气体;②实验①②的变量是温度;实验④比实验②多加0.1g催化剂 MnSO4;实验②③是探究H2C2O4溶液浓度对化学反应速率的影响,应控制KMnO4的浓度相同;要计算反应速率,需测量高锰酸钾溶液褪色所需时间;③根据![]() 计算v(KMnO4);④实验②的反应温度比实验①低,所以反应速率慢,褪色消耗时间多;(2)①中和热是生成1mol水放出的热量;②第2次实验数据明显偏离正常的误差范围,根据1、3、4三次实验数据计算平均温度差,根据Q=mc△T计算60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液反应放出的热量;③中和热是强酸和强碱反应生成1mol水时放出的热量,依据Q=Q=mc△T来逐项分析。
计算v(KMnO4);④实验②的反应温度比实验①低,所以反应速率慢,褪色消耗时间多;(2)①中和热是生成1mol水放出的热量;②第2次实验数据明显偏离正常的误差范围,根据1、3、4三次实验数据计算平均温度差,根据Q=mc△T计算60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液反应放出的热量;③中和热是强酸和强碱反应生成1mol水时放出的热量,依据Q=Q=mc△T来逐项分析。
解析:(1)MnO4-被H2C2O4还原为Mn2+,H2C2O4被氧化为CO2气体,反应的离子方程式是2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;②实验①②的变量是温度,所以实验①②是探究温度对化学反应速率的影响;实验④比实验②多加0.1g催化剂 MnSO4,所以实验②④是探究催化剂对化学反应速率影响;实验②③是探究H2C2O4溶液浓度对化学反应速率的影响,应控制KMnO4的浓度相同,所以需要加入0.5mL蒸馏水,故a=0.5;要计算反应速率,需测量高锰酸钾溶液褪色所需时间;③三次实验平均用时13.5s;④实验②的反应温度比实验①低,所以反应速率慢,褪色消耗时间多,所以图像是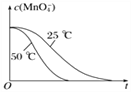 ;
;
(2)①中和热是生成1mol水放出的热量,稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式是H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l) △H=-114.6kJ/mol;②第2次实验明显偏离正常的误差范围,根据1、3、4三次实验数据,平均温度升高3.7℃,根据Q=mc△T,60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液反应放出的热量是(50+60)g![]() 4.18 J/(g·℃)
4.18 J/(g·℃) ![]() 3.7℃
3.7℃![]() kJ /J,60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液反应生成水的物质的量是0.06L
kJ /J,60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液反应生成水的物质的量是0.06L![]() 0.5mol/L,则△H=
0.5mol/L,则△H= 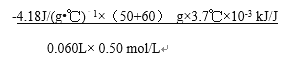 ;③A.实验装置保温、隔热效果差,测得中和热偏小,故A错误;B.量取NaOH溶液的体积时仰视读数,量取的氢氧化钠偏多,生成水的物质的量多,所以放出热量多,测得中和热数值偏大,故B正确;
;③A.实验装置保温、隔热效果差,测得中和热偏小,故A错误;B.量取NaOH溶液的体积时仰视读数,量取的氢氧化钠偏多,生成水的物质的量多,所以放出热量多,测得中和热数值偏大,故B正确;
C.用50mL0.50mol/L醋酸代替了硫酸进行反应,醋酸是弱酸,醋酸的电离是吸热的过程,所以导致实验测得中和热的数值偏小,故C错误;D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小,故D错误。E.由于硫酸本身就过量,量硫酸溶液的体积时仰视读数,生成水的物质的量不变,放热不变,实验测得中和热的数值无影响,故E错误。