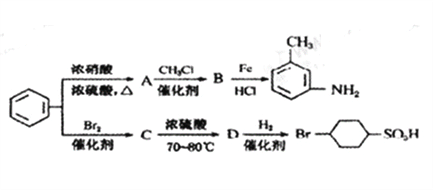
题目内容
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
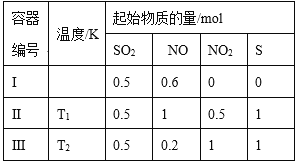
A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
【答案】AD
【解析】A. 根据图像,升高温度,c( NO2)减小,说明平衡逆向移动,因此正反应为放热反应,ΔH<0,故A正确;B. T1时,平衡是c( NO2)=0.2 mol/L,
SO2(g)+2NO(g)![]() 2NO2(g)+S(s)
2NO2(g)+S(s)
起始(mol/L) 0.5 0.6 0 0
反应(mol/L) 0.1 0.2 0.2
平衡(mol/L) 0.4 0.4 0.2
该反应的平衡常数K=![]() =
=![]() ,故B错误;C. T1时,容器I平衡时气体的物质的量为0.4+0.4+0.2=1.0mol,容器Ⅱ中Qc=
,故B错误;C. T1时,容器I平衡时气体的物质的量为0.4+0.4+0.2=1.0mol,容器Ⅱ中Qc=![]() =0.5<
=0.5<![]() ,说明反应正向移动,气体的物质的量小于0.5+1+0.5=2.0mol,因此达到平衡,总压强之比大于1:2,故C错误;D.根据上述分析,T1时,平衡时容器I中NO的体积分数为
,说明反应正向移动,气体的物质的量小于0.5+1+0.5=2.0mol,因此达到平衡,总压强之比大于1:2,故C错误;D.根据上述分析,T1时,平衡时容器I中NO的体积分数为![]() ×100%=40%;容器I相当于起始时加入0.2mol二氧化氮和0.6mol二氧化氮,容器Ⅲ相当于起始时加入0.4mol二氧化硫和1.2mol一氧化氮,容器Ⅲ相当于容器I缩小体积的结果,根据方程式,增大压强,平衡正向移动,一氧化氮的物质的量减少,因此平衡时容器Ⅲ中NO的体积分数小于40%,若T2<T1,降低温度,平衡正向移动,一氧化氮的物质的量更少,故D正确;故选AD。
×100%=40%;容器I相当于起始时加入0.2mol二氧化氮和0.6mol二氧化氮,容器Ⅲ相当于起始时加入0.4mol二氧化硫和1.2mol一氧化氮,容器Ⅲ相当于容器I缩小体积的结果,根据方程式,增大压强,平衡正向移动,一氧化氮的物质的量减少,因此平衡时容器Ⅲ中NO的体积分数小于40%,若T2<T1,降低温度,平衡正向移动,一氧化氮的物质的量更少,故D正确;故选AD。

【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:

(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______________。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________________。
(4)步骤Ⅲ中,加入锌粉的作用是______________。
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从硫酸锌溶液中获得硫酸锌晶体的实验操作为________________、冷却结晶、过滤。烘干操作需在减压低温条件下进行,原因是_________________________________。
(6)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680℃时所得固体的化学式为______。

a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O
【题目】(1)某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。
限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、MnSO4、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
①写出上述反应的离子方程式:________________________。
②上述实验①②是探究____________对化学反应速率的影响;上述实验②④是探究____________对化学反应速率
影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为______________;表格中的“乙”填写t/s,其测量的是______________________。
③实验①中对“乙”重复测量三次,所得数值分别13.6,13.5,13.4。忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___________ 。
④已知实验①50℃时c(MnO![]() )~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO
)~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO![]() )~t的变化曲线示意图。______________
)~t的变化曲线示意图。______________
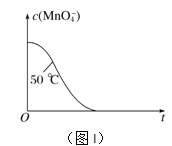
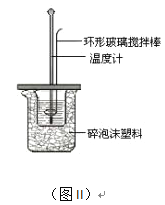
(2)测定中和热的实验装置如图II所示。
①写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式_______________________(中和热数值为57.3 kJ/mol):
②取60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.9 | |
2 | 26.2 | 26.4 | 26.3 | 30.6 | |
3 | 25.9 | 25.9 | 25.9 | 29.5 | |
4 | 26.4 | 26.2 | 26.3 | 30.0 | |
近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=________________________kJ/mol(列出计算式)。
③能引起中和热偏高的原因是(填字母)__________。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.用50mL0.50mol/L醋酸代替了硫酸进行反应,
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
E. 量取硫酸溶液的体积时仰视读数