题目内容
【题目】铬是广泛存在于环境中的金属元素,在水体中主要以三价和六价铬的化合物为主,其中六价铬对人有害。通常含六价铬的酸性工业废水的处理流程为:
![]()
请回答下列问题:
I.(1)第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
a.Cr2O72-和CrO42-的浓度相同 b.2v (Cr2O72-) = v (CrO42-) c.溶液的颜色保持不变
(2)常温下,向100mL、0.1mol/L的K2CrO4溶液加入1mol/L硫酸10mL,存在平衡:
2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O K=5×1014
Cr2O72-(橙色)+H2O K=5×1014
若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转:Cr2O72-(橙色) +2OH-![]() 2CrO42-(黄色) +H2O
2CrO42-(黄色) +H2O
设该反应的平衡常数为K1,则K1=_______________。
II.为进一步研究初始pH和草酸浓度对第②步反应速率的影响,某学习小组设计对比实验如下表:
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
甲 | 4 | 60 | 10 | 30 |
乙 | 5 | x | 10 | 30 |
丙 | 5 | y | 5 | z |
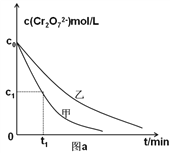
(3)实验设计表中z=_______mL;
(4)实验甲中0~t1时间段反应速率v(Cr3+)=________mol/(L·min) (用含字母的代数式表示)。
(5)常温下,第③步生成的Cr(OH)3在溶液中存在以下平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
【答案】 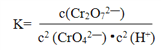 c 2×1013 35 2(c0-c1)/t1 5(或≥5)
c 2×1013 35 2(c0-c1)/t1 5(或≥5)
【解析】I.(1)第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,该反应的平衡常数表达式为
Cr2O72-(橙色)+H2O,该反应的平衡常数表达式为 。第①步反应的下列状态中:a.Cr2O72-和CrO42-的浓度相同,不能说明它们的浓度保持不变;b.2v (Cr2O72-) = v (CrO42-) 不能代表正反应速率与逆反应速率相等;c.溶液的颜色保持不变,说明反应混合物中各组分的浓度均保持不变,即达到平衡状态。综上所述,一定达到平衡的是c。
。第①步反应的下列状态中:a.Cr2O72-和CrO42-的浓度相同,不能说明它们的浓度保持不变;b.2v (Cr2O72-) = v (CrO42-) 不能代表正反应速率与逆反应速率相等;c.溶液的颜色保持不变,说明反应混合物中各组分的浓度均保持不变,即达到平衡状态。综上所述,一定达到平衡的是c。
(2)常温下,向100mL、0.1mol/L的K2CrO4溶液加入1mol/L硫酸10mL,存在平衡:
2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O ,K=5×1014;若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转为Cr2O72-(橙色) +2OH-
Cr2O72-(橙色)+H2O ,K=5×1014;若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转为Cr2O72-(橙色) +2OH-![]() 2CrO42-(黄色) +H2O,设该反应的平衡常数为K1,则K1=
2CrO42-(黄色) +H2O,设该反应的平衡常数为K1,则K1=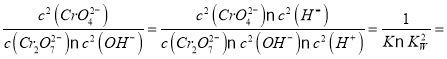 2×1013。
2×1013。
II.(3)根据控制变量法的原理可知,要保证废水样品相同、混合后总体积相同,即x=60、y=60,所以实验设计表中z=35;
(4)实验甲中0~t1时间段反应速率v(Cr3+)=2 v(Cr2O72-)=![]() mol/(L·min)。
mol/(L·min)。
(5)常温下,第③步生成的Cr(OH)3在溶液中存在以下平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,则
Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,则![]() ,即c(OH-)≥10-9mol/L,所以溶液的pH应调至5(或≥5)。
,即c(OH-)≥10-9mol/L,所以溶液的pH应调至5(或≥5)。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】结合所学内容回答下列问题:
Ⅰ.某实验小组以H2O2的分解为例,研究浓度、催化剂、温度对化学反应速率的影响,按照如下方案设计实验。
实验编号 | 反应物 | 催化剂 | 温度 |
① | 10 mL 2% H2O2溶液 | 无 | 20℃ |
② | 10 mL 5% H2O2溶液 | 无 | 20℃ |
③ | 10 mL 5% H2O2溶液 | 1-2滴1 mol/LFeCl3溶液 | 20℃ |
④ | 10 mL 5% H2O2溶液 | 无 | 20℃ |
⑤ | 10 mL 5% H2O2溶液 | ||
⑥ | 无 | 20℃ |
(1)实验①和②的目的是研究_______________对反应速率的影响。
(2)实验③和④测得生成氧气的体积随时间变化的关系如下图所示。
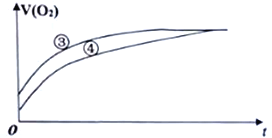
分析上图能够得出的实验结论是________________________________________________。
(3)实验⑤和⑥是研究温度相差10℃对反应速率的影响,请在上面表格空白处补齐对应的内容_________。
Ⅱ.某温度时,在2L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
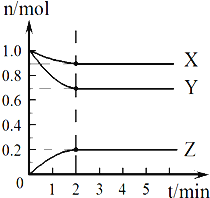
(4)反应开始至2 min,Z的平均反应速率____________。
(5)保持容器容积不变,在第2min时改变下列条件时,化学反应速率的变化是:
①向其中充入1 molX气体,化学反应速率_______(填 “加快”“减慢”或“不变”,下同);
②向其中充入1 mol N2(g) (N2不参加反应),化学反应速率_______________;
③同时加入0.9molX、0.7molY 和0.2molZ,化学反应速率________________。