题目内容
【题目】某同学用中和滴定法测定某烧碱样品的纯度。实验步骤如下:
Ⅰ.配制待测液:用托盘天平称量5.0g烧碱样品(杂质不与盐酸反应),配制成1000mL溶液。
Ⅱ.滴定:取20.00mL所配待测液用0.10mol/L的盐酸标准液进行滴定,达到滴定终点后重复此操作两次。
Ⅲ.记录数据如下:
测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 20.00 | 0.50 | 20.64 |
2 | 20.00 | 1.20 | 24.32 |
3 | 20.00 | 1.30 | 21.40 |
请根据上述实验回答以下问题:
(1)配制待测液时,除烧杯和玻璃棒外,还需要用到的主要玻璃仪器有_____。
(2)盛装0.10mol/L的盐酸标准液应该使用____滴定管(选填“酸式”或“碱式”),滴定时眼睛应注意观察_____。
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,测定结果_____;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果____;
③读数时,滴定前俯视,滴定后仰视,测定结果_____。
(4)计算纯度:烧碱样品的纯度是_____(保留一位小数)。
【答案】1000mL容量瓶、胶头滴管 酸式 锥形瓶中溶液颜色的变化 无影响 偏高 偏高 80.5%
【解析】
根据溶液配制和中和滴定操作步骤分析解题,结合c(待测)=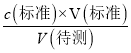 分析误差。
分析误差。
(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的玻璃仪器为:烧杯、玻璃棒、1000mL容量瓶、胶头滴管;
(2)盛装0.10mol/L的盐酸标准溶液应该使用酸式滴定管,滴定时眼睛应注意观察锥形瓶中溶液颜色的变化;
(3)①滴定前用蒸馏水冲洗锥形瓶,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=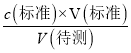 分析,可知c(待测)无影响;
分析,可知c(待测)无影响;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,造成V(标准)偏大,根据c(待测)=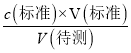 分析,可知c(待测)偏高;
分析,可知c(待测)偏高;
③读数时,若滴定前俯视,滴定后仰视,造成V(标准)偏大,根据c(待测)=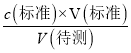 分析,可知c(待测)偏高;
分析,可知c(待测)偏高;
(4)三次消耗盐酸体积分别为:20.64ml-0.50ml=20.14ml、24.32ml-1.20ml=23.12ml;21.40ml-1.3ml=20.10ml,第二次数据误差明显偏大,舍去,第一次和第三次消耗盐酸的平均体积为20.12mL,原溶液中n(NaOH)=![]() ×n(HCl)=50×0.10 mol/L×20.12mL×10-3=0.1006mol,所以烧碱的纯度为
×n(HCl)=50×0.10 mol/L×20.12mL×10-3=0.1006mol,所以烧碱的纯度为![]() ≈80.5%。
≈80.5%。