题目内容
16.煤中含有硫,若在煤中掺入适量生石灰,则在煤的燃烧过程中可以减少空气中二氧化硫的含量,其原因是(用方程式表示)SO2+CaO=CaSO3、2CaSO3+O2=2CaSO4.某化学兴趣小组采集到一份酸雨样品,他们每隔一定时间测定酸雨的pH,发现开始的一段时间酸雨的pH在变小(变小、变大或不变),用方程式解释原因2H2SO3+O2=2H2SO4.分析 二氧化硫为酸性氧化物,能够与碱性氧化物反应生成亚硫酸钙,亚硫酸钙不稳定,被空气中的氧气氧化生成硫酸钙,起到固硫的作用;
二氧化硫与水反应生成弱酸亚硫酸,亚硫酸不稳定被氧气氧化生成强酸硫酸,所以一段时间酸雨的pH变小.
解答 解:二氧化硫为酸性氧化物,能够与碱性氧化物反应生成亚硫酸钙,亚硫酸钙不稳定,被空气中的氧气氧化生成硫酸钙,反应的化学方程式:SO2+CaO=CaSO3 2CaSO3+O2=2CaSO4;
酸雨形成的主要原因是:大量燃烧化石燃料(煤和石油等),产生二氧化硫,随雨降落形成;
酸雨样品放置,发生的反应为:2H2SO3+O2=2H2SO4,酸雨样品中的弱酸H2SO3逐渐被氧化成强酸H2SO4,使溶液的酸性增强,
故答案为:SO2+CaO=CaSO3、2CaSO3+O2=2CaSO4;变小;2H2SO3+O2=2H2SO4.
点评 本题考查酸雨的形成、硫元素化合物的性质等,明确二氧化硫性质是解题关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
7.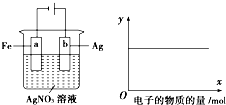 按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )
按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )
 按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )
按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )| A. | ①③ | B. | ③④ | C. | ①②④ | D. | ①② |
4.下列含硫化合物中,硫元素既有氧化性又有还原性的是( )
| A. | S | B. | H2S | C. | SO2 | D. | SO3 |
11.下列能够确定溶液中一定含有SO42-的事实是( )
| A. | 取少量试液,加入用盐酸酸化的氯化钡溶液,有白色沉淀生成 | |
| B. | 取少量试液,加入氯化钡溶液,有白色沉淀生成,再加稀硝酸沉淀不消失 | |
| C. | 取少量试液,加入硝酸钡溶液,有白色沉淀生成 | |
| D. | 取少量试液,加入盐酸无现象,再加氯化钡溶液,有白色沉淀生成 |
1.4NH3+5O2≒4NO+6H2O反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的反应速率为( )
| A. | V(O2)=0.01mol/L•s | B. | V(NO)=0.008mol/L•s | ||
| C. | V(H2O)=0.003mol/L•min | D. | V(NH3)=0.002mol/L•s |
17.从溴乙烷制取1.2-二溴乙烷,下列转化方案中最好的是( )
| A. | CH3CH2Br$\stackrel{NaOH水溶液}{→}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
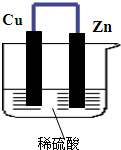 如图所示,将锌、铜通过导线相连,置于稀硫酸中.
如图所示,将锌、铜通过导线相连,置于稀硫酸中. .
.