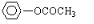题目内容
6.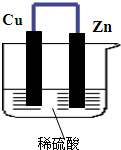 如图所示,将锌、铜通过导线相连,置于稀硫酸中.
如图所示,将锌、铜通过导线相连,置于稀硫酸中.(1)锌片电极反应为:Zn-2e-=Zn2+.
(2)铜片上的现象是:铜片上有气泡产生.
(3)电子的流向由锌片经导线流向铜电极.
(4)当通过导线的电子为0.8mol时,收集到氢气的体积是(标况下)8.96L.
(5)若将电解质溶液换成氯化铁溶液,能否形成原电池?若能,请写出正极反应式,若不能请说明理由.Fe3++e-=Fe2+.
分析 该原电池中,Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为2H++2e-=H2↑,导致负极上金属逐渐减少,正极上有气泡产生,电子从负极流向正极,据此
解答 解:(1)该原电池中,Zn易失电子作负极、Cu作正极,负极上铁失电子发生氧化反应生成锌离子进入溶液,电极反应式为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(2)Cu作正极,正极上电极反应式为2H++2e-=H2↑,故铜片上有气泡产生,故答案为:铜片上有气泡产生;
(3)负极失去电子经过导线流向正极,故答案为:由锌片经导线流向铜电极;
(4)正极:2H++2e-=H2↑,每当有2mol电子转移生成1mol氢气,故转移电子为0.8mol时,故生成氢气体积为:$\frac{0.8mol}{2mol}$×22.4L/mol=8.96L,故答案为:8.96L;
(5)电解质若换成氯化铁溶液,铁离子氧化性比氢离子强,故优先放电,正极反应方程式为:Fe3++e-=Fe2+,此反应为氧化还原反应,故可以形成原电池,故答案为:Fe3++e-=Fe2+.
点评 本题主要考查了原电池,明确正负极的判断方法及电极上发生的反应是解本题关键,根据电极反应确定发生的现象,题目难度不大.

练习册系列答案
相关题目
16.近20年来,同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用;如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境指示物.下列有关说正确的是( )
| A. | 34S原子核内中子数为16 | B. | 1H218O的摩尔质量为20g/mol | ||
| C. | 13C和15N原子核内的质子数相差2 | D. | 2H+的核外电子数为2 |
17.用NA表示阿佛加德罗常数,下列说法中正确的是( )
| A. | 1摩铜作还原剂一定提供NA个电子 | |
| B. | 64克二氧化硫中含有NA个氧分子 | |
| C. | 标准状况下,22.4升氨气中含有3NA个氢原子 | |
| D. | 18克重水中含有10NA个电子 |
14.在一定温度下,某固定容积的密闭容器中发生如下反应2NO2?2NO+O2.此反应达到平衡状态的标志是( )
| A. | NO2、NO、O2的物质的量浓度之比为2:2:1 | |
| B. | 单位时间内生成n mol O2,同时消耗2n mol NO2 | |
| C. | 混合气体的平均摩尔质量不再改变 | |
| D. | 正反应和逆反应都已停止 |
11.2010年1月13日海地发生里氏7.3级大地震,为防止大灾后疫病流行,需大量各种消毒剂.过碳酸钠化学式为Na2CO3•3H2O2,具有Na2CO3和H2O2的双重性质.过碳酸钠与下列物质均会发生反应而失效,其中过碳酸钠只发生氧化反应而被氧化的是( )
| A. | MnO2 | B. | 稀盐酸 | C. | Na2SO3溶液 | D. | KMnO4溶液 |
18.已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )

| A. | 分子中至少有12个碳原子处于同一平面上 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 该烃属于苯的同系物 |
15.如图示为一种天然产物,具有一定的除草功效.下列有关该化合物的说法错误的是( )
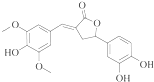

| A. | 分子中含有三种含氧官能团 | |
| B. | 1 mol该化合物最多能与6molNaOH反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 既能与FeC13发生显色反应,也能和Na2CO3反应 |
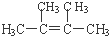 ;
;

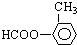 还有:
还有: .
. .
.