题目内容
某一反应的反应物和产物共有下列六种:FeSO4; N2O;Fe2(SO4)3; HNO3; Fe(NO3)3和H2O则该反应中还原产物为
- A.FeSO4
- B.HNO3
- C.Fe2(SO4)3
- D.N2O
分析:因硝酸是常见的氧化剂,反应物中FeSO4具有还原性,则该反应为FeSO4与HNO3发生的氧化还原反应,以此来解答.
解答:由给出的物质的性质可知,硝酸具有氧化性,FeSO4具有还原性,
该反应为FeSO4与HNO3发生的氧化还原反应,
N元素的化合价降低被还原,对应的生成物N2O为还原产物,
故选D.
点评:本题考查氧化还原反应,明确元素的化合价是解答本题的关键,不需要书写氧化还原方程式即可解答,难度不大.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g)
△H
2Fe(s)+3CO2(g)
△H
(1)已知:①Fe2O3(s) + 3C(石墨)=2Fe(s) + 3CO(g) △H1
②C(石墨)+ CO2(g) = 2CO(g) △H2
则△H___________________(用含△H1 、△H2的代数式表示)。
(2)高炉炼铁反应的平衡常数表达式K=____________________________。
(3)在某温度时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
|
|
Fe2O3 |
CO |
Fe |
CO2 |
|
甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
|
乙/mol |
1.0 |
1.5 |
1.0 |
1.0 |
①甲容器中CO的平衡转化率为_______________________。
②下列说法正确的是____________________(填编号)。
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
II.纳米MgO可用尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
|
编号 |
温度/K |
反应时间/h |
反应物物质的量配比 |
实验目的 |
|
① |
378 |
4 |
3∶1 |
实验②和④探究________ ______________________ 实验②和__________探究 反应时间对产率的影响。 |
|
② |
378 |
4 |
4∶1 |
|
|
③ |
378 |
3 |
_______ |
|
|
④ |
398 |
4 |
4∶1 |
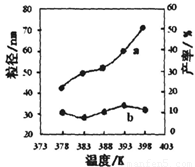
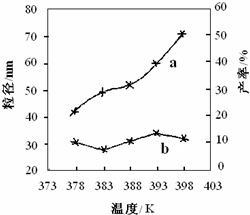
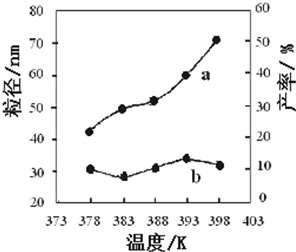
下图为温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请归纳出温度对纳米MgO制备的影响规律(写出一条):
___________________________________________。

 I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为: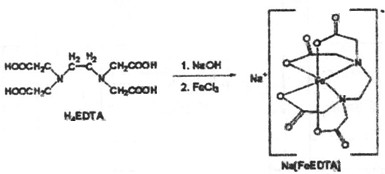
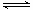 2NH3(g)
ΔH=-92.4
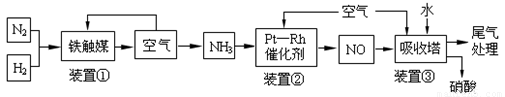
kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)
ΔH=-92.4
kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)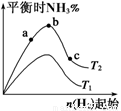
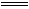 2NO(g) ΔH=+180.5 kJ·mol-1
2NO(g) ΔH=+180.5 kJ·mol-1