题目内容
 I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1
②C(石墨)+CO2(g)=2CO(g)△H2,则△H=
(2)高炉炼铁反应的平衡常数表达式K=
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是
A.若容器压强恒定,反应达到平衡状态 B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的 D.增加Fe2O3就能提高CO的转化率
II.纳米MgO可用尿素与氯化镁合成.某小组研究该反应在温度为378~398K时的反应
时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究 实验②和 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |
(2)化学平衡常数是指平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、纯液体的浓度为常数,不需要写固体、纯液体;
(3)①令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数,而平衡常数为64计算出n的值,再利用转化率定义计算CO的转化率;
②A、反应前后气体体积没有变化的反应,容器中的压强不再发生变化,不能证明达到了平衡状态;
B、容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量会变,所以容器内气体的密度会变,当容器中气体的密度不再发生变化时,能表明达到化学平衡状态;
C、反应前后气体体积没有变化的反应,增加反应物气体的物质的量平衡不发生移动;
D、增加固体的物质的量,不影响平衡移动;
II. 根据控制变量法进行对比试验,研究温度、反应时间、反应物配比对氧化镁产率,分析对比实验的变量不同进行解答.
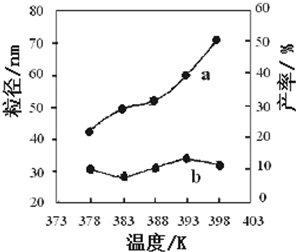
由图表中数据可知,在378K~398K,纳米MgO的粒径大小无明显变化,在383K较低温度下有利于形成较小的颗粒,纳米MgO产率随温度的升高而增大;
C(石墨)+CO2(g)=2CO(g)△H2 ②
由①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=△H1-3△H2,
故答案为:△H1-3△H2;
(2)反应Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)的平衡常数K=
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
(3)①令平衡时CO的物质的量变化为nmol,则:
Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)
开始(mol):1 1 1 1
变化(mol):n n n n
平衡(mol):1-n 1-n n n
所以K=
| c3(CO2) |
| c3(CO) |
| n3(CO2) |
| n3(CO) |
| n 3 |
| (1-n ) 3 |
| 0.6mol |
| 1mol |
②②A、该反应是反应前后气体体积没有变化的反应,容器中的压强不再发生变化,不能证明达到了平衡状态,故A错误;
B、该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量会变,所以容器内气体的密度会变,当容器中气体的密度不再发生变化时,能表明达到化学平衡状态,故B正确;
C、该反应是反应前后气体体积没有变化的反应,增加反应物气体的物质的量平衡不发生移动,转化率不变,故C错误;
D、氧化铁是固体,增加Fe2O3的量,不影响平衡移动,故D错误;
故选:B.
II.实验根据控制变量法进行对比试验,研究温度、反应时间、反应物配比对氧化镁产率的影响.
实验①和③,温度相同,反应时间相同,应研究反应物配比对氧化镁产率的影响,③中反应物配比应为4:1;
实验②和④,反应时间相同,反应物配比相同,温度不同,应是探究温度对产率的影响;
③中反应物配比应为4:1,实验②和③,温度相同、反应物配比相同,反应时间不同,探究反应时间对产率的影响.
故答案为:4:1;温度对产率的影响;③;
由图表中数据可知,在378K~398K,纳米MgO的粒径大小无明显变化,在383K较低温度下有利于形成较小的颗粒,纳米MgO产率随温度的升高而增大.
故答案为:在378K~398K,纳米MgO的粒径大小无明显变化,在383K较低温度下有利于形成较小的颗粒,纳米MgO产率随温度的升高而增大.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g)
△H
2Fe(s)+3CO2(g)
△H
(1)已知:①Fe2O3(s) + 3C(石墨)=2Fe(s) + 3CO(g) △H1
②C(石墨)+ CO2(g) = 2CO(g) △H2
则△H___________________(用含△H1 、△H2的代数式表示)。
(2)高炉炼铁反应的平衡常数表达式K=____________________________。
(3)在某温度时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
|
|
Fe2O3 |
CO |
Fe |
CO2 |
|
甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
|
乙/mol |
1.0 |
1.5 |
1.0 |
1.0 |
①甲容器中CO的平衡转化率为_______________________。
②下列说法正确的是____________________(填编号)。
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
II.纳米MgO可用尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
|
编号 |
温度/K |
反应时间/h |
反应物物质的量配比 |
实验目的 |
|
① |
378 |
4 |
3∶1 |
实验②和④探究________ ______________________ 实验②和__________探究 反应时间对产率的影响。 |
|
② |
378 |
4 |
4∶1 |
|
|
③ |
378 |
3 |
_______ |
|
|
④ |
398 |
4 |
4∶1 |
下图为温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请归纳出温度对纳米MgO制备的影响规律(写出一条):
___________________________________________。

