题目内容
对溶液的研究和认识,在生产、生活和科研领域具有重要意义.
(1)现有一种含有弱酸HA和其钠盐NaA的溶液,请回答下列问题:
①组成该溶液的微观粒子有 .
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是 ;
③若向该溶液中逐滴加入KOH溶液时,下列图象能表示Aˉ离子数目变化趋势的是 ;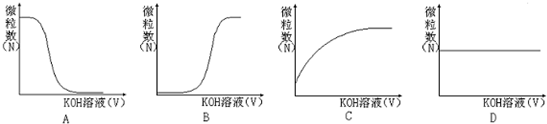
④现将1体积0.04mol?L-1HA溶液和1体积0.02mol?L-1NaOH溶液混合,得到2体积混合溶液.若该混合液显碱性,则其c(A-) 0.01mol?L-1(填“<”、“=”或“>”);若该混合液显酸性,溶液中所有离子的浓度由大到小的顺序是 .
(2)血液里含有的H2CO3和NaHCO3,与上述情况相似,对保持血液pH的稳定起到重要作用.
当c(H+)增大时,血液中消耗H+的离子方程式为 ;
当c(OH-)增大时,血液的pH也能保持基本稳定,试结合离子方程式简要说明 .
(1)现有一种含有弱酸HA和其钠盐NaA的溶液,请回答下列问题:
①组成该溶液的微观粒子有
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是
③若向该溶液中逐滴加入KOH溶液时,下列图象能表示Aˉ离子数目变化趋势的是

④现将1体积0.04mol?L-1HA溶液和1体积0.02mol?L-1NaOH溶液混合,得到2体积混合溶液.若该混合液显碱性,则其c(A-)
(2)血液里含有的H2CO3和NaHCO3,与上述情况相似,对保持血液pH的稳定起到重要作用.
当c(H+)增大时,血液中消耗H+的离子方程式为
当c(OH-)增大时,血液的pH也能保持基本稳定,试结合离子方程式简要说明
分析:(1)①溶液中存在酸根离子的水解平衡、水的电离平衡、酸和盐的电离,据此判断溶液中存在的微粒;
②弱酸根离子能和强酸反应生成弱酸;
③向混合溶液中加入氢氧化钠时,氢氧化钠和酸反应生成盐,促进酸的电离;
④二者混合后,溶液中的溶质是等物质的量浓度的NaA和HA,混合溶液呈碱性,说明酸根离子水解程度大于HA的电离程度;若混合溶液呈酸性,则酸根离子水解程度小于HA的电离程度,根据溶液的酸碱性结合电荷守恒判断离子浓度大小;
(2)溶液中存在碳酸氢根离子的水解、碳酸的电离等平衡,c(H+)增大时,溶液中碳酸氢根离子和氢离子反应,c(OH-)增大时,碳酸和氢氧根离子反应生成碳酸氢根离子.
②弱酸根离子能和强酸反应生成弱酸;
③向混合溶液中加入氢氧化钠时,氢氧化钠和酸反应生成盐,促进酸的电离;
④二者混合后,溶液中的溶质是等物质的量浓度的NaA和HA,混合溶液呈碱性,说明酸根离子水解程度大于HA的电离程度;若混合溶液呈酸性,则酸根离子水解程度小于HA的电离程度,根据溶液的酸碱性结合电荷守恒判断离子浓度大小;
(2)溶液中存在碳酸氢根离子的水解、碳酸的电离等平衡,c(H+)增大时,溶液中碳酸氢根离子和氢离子反应,c(OH-)增大时,碳酸和氢氧根离子反应生成碳酸氢根离子.
解答:解:(1)①HA为弱电解质,存在电离平衡,水是弱电解质,存在电离平衡,NaA为强电解质,完全电离,所以溶液中存在的微粒有H2O、HA、H+、OH-、A-、Na+,
故答案为:H2O、HA、H+、OH-、A-、Na+;
②若向该溶液中加入少量盐酸时,氯化氢电离出的氢离子和酸根离子反应生成HA,其离子反应方程式为A-+H+?HA,故答案为:A-+H+?HA;
③若向该溶液中加入氢氧化钾溶液时,氢氧根离子和氢离子反应生成水,从而促进HA的电离,导致溶液中酸根离子数目增大,当完全反应时,酸根离子浓度最大,故选C;
④二者混合后,溶液中的溶质是等物质的量浓度的NaA和HA,混合溶液呈碱性,说明酸根离子水解程度大于HA的电离程度,二者混合时溶液体积增大一倍,所以c(A-)<0.01mol?L-1;
若混合溶液呈酸性,则酸根离子水解程度小于HA的电离程度,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(A-)>c(Na+),酸的电离程度较小,所以溶液中存在c(Na+)>c(H+),则该溶液中离子浓度大小顺序是c(A-)>c(Na+)>c(H+)>c(OH-),
故答案为:<;c(A-)>c(Na+)>c(H+)>c(OH-);
(2)溶液中存在碳酸氢根离子的水解、碳酸的电离等平衡,c(H+)增大时,溶液中碳酸氢根离子和氢离子反应,离子反应方程式为HCO3-+H+?H2CO3,
c(OH-)增大时,碳酸和氢氧根离子反应生成碳酸氢根离子,离子反应方程式为H2CO3+OH-?HCO3-+H2O,
如果向溶液中加入碱时,碳酸和氢氧根离子反应生成碳酸氢根离子,导致溶液碱性减弱,
故答案为:HCO3-+H+?H2CO3;H2CO3+OH-?HCO3-+H2O,向溶液中加入碱时,碳酸和氢氧根离子反应生成碳酸氢根离子,导致溶液碱性减弱.
故答案为:H2O、HA、H+、OH-、A-、Na+;
②若向该溶液中加入少量盐酸时,氯化氢电离出的氢离子和酸根离子反应生成HA,其离子反应方程式为A-+H+?HA,故答案为:A-+H+?HA;
③若向该溶液中加入氢氧化钾溶液时,氢氧根离子和氢离子反应生成水,从而促进HA的电离,导致溶液中酸根离子数目增大,当完全反应时,酸根离子浓度最大,故选C;
④二者混合后,溶液中的溶质是等物质的量浓度的NaA和HA,混合溶液呈碱性,说明酸根离子水解程度大于HA的电离程度,二者混合时溶液体积增大一倍,所以c(A-)<0.01mol?L-1;
若混合溶液呈酸性,则酸根离子水解程度小于HA的电离程度,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(A-)>c(Na+),酸的电离程度较小,所以溶液中存在c(Na+)>c(H+),则该溶液中离子浓度大小顺序是c(A-)>c(Na+)>c(H+)>c(OH-),
故答案为:<;c(A-)>c(Na+)>c(H+)>c(OH-);
(2)溶液中存在碳酸氢根离子的水解、碳酸的电离等平衡,c(H+)增大时,溶液中碳酸氢根离子和氢离子反应,离子反应方程式为HCO3-+H+?H2CO3,
c(OH-)增大时,碳酸和氢氧根离子反应生成碳酸氢根离子,离子反应方程式为H2CO3+OH-?HCO3-+H2O,
如果向溶液中加入碱时,碳酸和氢氧根离子反应生成碳酸氢根离子,导致溶液碱性减弱,
故答案为:HCO3-+H+?H2CO3;H2CO3+OH-?HCO3-+H2O,向溶液中加入碱时,碳酸和氢氧根离子反应生成碳酸氢根离子,导致溶液碱性减弱.
点评:本题考查了弱电解质的电离、离子浓度大小的比较、盐类水解等知识点,明确弱电解质的电离特点、盐类水解特点结合电荷守恒来分析解答,注意(2)中加入酸或碱时,溶液酸碱性变化不大,该溶液为缓冲溶液.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目

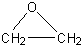 +CaCl2+H2O
+CaCl2+H2O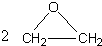


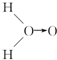 (式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
(式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)