题目内容
20.含甲醛0.15g的水溶液,跟足量的银氨溶液共热时,最多可生成银的质量是( )| A. | 0.54g | B. | 1.08g | C. | 1.62g | D. | 2.16g |
分析 甲醛溶液与足量的银氨溶液共热发生HCHO+4[Ag(NH3)2]++4OH$\stackrel{水浴}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O,结合方程式计算.
解答 解:n(HCHO)=$\frac{0.15g}{30g/mol}$=0.005mol,
由HCHO+4[Ag(NH3)2]++4OH$\stackrel{水浴}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O
1 4
0.005mol n(Ag)
n(Ag)=0.005mol×4=0.02mol,
则m(Ag)=0.02mol×108g/mol=2.16g,
故选D.
点评 本题以化学计算为载体考查学生对甲醛结构、醛基性质的理解,为高频考点,把握量的关系为解答的关键,题目难度中等,注意方程式的书写,为易错点.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 油脂是植物油和动物脂肪的统称,分子的不饱和程度越大,熔点越低 | |
| B. | 氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应,是两性氧化物 | |
| C. | 石油经裂化得到的汽油可用来萃取溴水中的Br2 | |
| D. | 麻黄碱(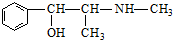 )的催化氧化产物能发生银镜反应 )的催化氧化产物能发生银镜反应 |
8.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法正确的是( )
| A. | X的氢化物溶于水显酸性且稳定性弱于HF | |
| B. | Y的氧化物是离子化合物,Y的氢氧化物碱性比氢氧化钠弱 | |
| C. | Z的氢化物的水溶液在空气中存放不易变质 | |
| D. | X和Z的最高价氧化物对应的水化物都是弱酸 |
15.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| B. | 常温下,1L 0.1mol/LNa2S溶液中,含有S2-数为0.1NA | |
| C. | 7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA | |
| D. | 在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3 mol Cl2转移的电子数为6NA |
5.从苯酚的乙醇溶液中回收苯酚的实验中,操作步骤合理的是( )
①蒸馏 ②过滤 ③静置分液 ④加入足量钠 ⑤通入足量CO2⑥加入足量NaOH溶液 ⑦加入乙酸和浓硫酸的混合液加热.
①蒸馏 ②过滤 ③静置分液 ④加入足量钠 ⑤通入足量CO2⑥加入足量NaOH溶液 ⑦加入乙酸和浓硫酸的混合液加热.
| A. | ④⑤③ | B. | ⑥①⑤③ | C. | ③⑤①② | D. | ⑥① |
9.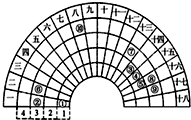 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A. | 对应简单离子半径②>⑧>⑨ | |
| B. | 简单氢化物稳定性⑤>⑧ | |
| C. | 最高价氧化物对应的水化物酸性⑨>⑧>⑦ | |
| D. | ①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
10.下列有关物质的性质或用途的叙述中,错误的是( )
| A. | 硅晶体是一种重要的半导体材料 | |
| B. | 石墨可用做绝缘材料 | |
| C. | 漂白粉的有效成分是次氯酸钙 | |
| D. | 常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车 |


 有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示: