题目内容
1.下列离子方程式书写正确的是( )| A. | 氯气溶于水:Cl2+H2O=2H++C1-+C1O- | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++4OH-=AlO2-+2H2O | |
| C. | FeS04溶液与稀硝酸反应:3Fe2++NO3-+4H+=3Fe3++NO+2H2O | |
| D. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
分析 A.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
B.氨水为弱碱,二者反应生成氢氧化铝沉淀;
C.亚铁离子被稀硝酸氧化成铁离子;
D.铁与稀硫酸反应生成硫酸亚铁和氢气.
解答 解:A.氯气与水反应生成氯化氢和次氯酸,次氯酸不能拆开,正确的离子方程式为:Cl2+H2O=H++C1-+HC1O,故A错误;
B.氯化铝与氨水反应生成氢氧化铝沉淀和硫酸铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.FeS04溶液与稀硝酸发生氧化还原反应,正确的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO+2H2O,故C正确;
D.铁与稀硫酸反应生成的是亚铁离子,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故D错误;
故选C.
点评 本题考查了离子方程式的书写方法判断,题目难度不大,明确离子方程式的书写原则为解答关键,试题侧重基础知识的考查,有利于培养学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是( )
| A. | Na+、Ba2+、Cl-、SO42- | B. | H+、NH4+、Al3+、SO42- | ||
| C. | H+、Fe2+、NO3-、Cu2+ | D. | K+、AlO2-、CH3COO-、NO3- |
12.如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
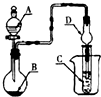

| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 若A为醋酸,B为碳酸钙,C中盛澄清石灰水,则C中溶液变浑浊 | |
| C. | 若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀,后沉淀又溶解 | |
| D. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
9.下列物质的制备操作,可以达到实验目的是( )
| A. | 向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体 | |
| B. | 用铁和Cl2加热制取FeCl3 | |
| C. | 用铜粉和硫粉混合加热制备CuS | |
| D. | 向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3 |
16.向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化,如图所示,各条曲线与溶液中离子数目的大致对应关系描述正确的是( )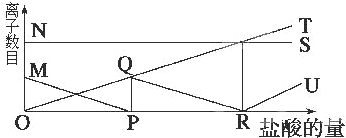

| A. | NS:K+; MP:H+; QR:CO32-; OT:HCO3-; RU:Cl- | |
| B. | NS:K+; MP:CO32-; OQR:HCO3-; OT:Cl-; RU:H+ | |
| C. | NS:K+; MP:Cl-; QR:H+; OT:HCO3-; RU:CO32- | |
| D. | NS:K+; MP:H+; OQR:Cl-; OT:C32-; RU:HCO3- |
13.下列表示正确的是( )
| A. | CO2的电子式: | B. | 乙烯的结构式:CH2═CH2 | ||
| C. | CH4的比例模型: | D. | Cl-离子的结构示意图: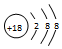 |