题目内容
16.向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化,如图所示,各条曲线与溶液中离子数目的大致对应关系描述正确的是( )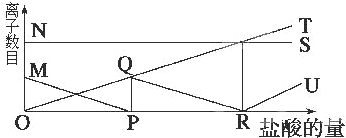
| A. | NS:K+; MP:H+; QR:CO32-; OT:HCO3-; RU:Cl- | |
| B. | NS:K+; MP:CO32-; OQR:HCO3-; OT:Cl-; RU:H+ | |
| C. | NS:K+; MP:Cl-; QR:H+; OT:HCO3-; RU:CO32- | |
| D. | NS:K+; MP:H+; OQR:Cl-; OT:C32-; RU:HCO3- |
分析 K2CO3在溶液中电离出K+和CO32-,盐酸溶液中存在H+、Cl-,因而出现CO32-+H+═HCO3-,然后HCO3-+H+═H2O+CO2↑,因而向一定量的K2CO3溶液中缓慢地滴加稀盐酸,结合发生的反应分析.
解答 解:K2CO3在溶液中电离出K+和CO32-,盐酸溶液中存在H+、Cl-,因而出现CO32-+H+═HCO3-,然后HCO3-+H+═H2O+CO2↑,Cl-没有发生反应生成气体、沉淀、水,所以随着稀盐酸的加入,Cl-的数目正比例上升,是曲线OT;K+也不反应,且始终在溶液中的数目不变,是曲线NS;
又因为开始CO32-+H+═HCO3-,所以CO32-的数目减少,是曲线MP,HCO3-的数目增加,后来HCO3-+H+═H2O+CO2↑,所以HCO3-的数目又减少,是曲线OQR,
当盐酸过量时,氢离子浓度逐渐增大,其曲线为RU;
所以曲线与溶液中的离子的对应关系完全正确的是B.
故选B.
点评 本题考查了碳酸盐与HCl的反应、离子浓度的变化曲线,题目难度中等,明确溶液中发生的反应以及离子浓度的变化是解题的关键,侧重于考查学生的分析能力.

练习册系列答案
相关题目
6.在无色的酸性溶液中可以大量共存的离子组是( )
| A. | Fe2+ NO3- I-SO42- | B. | MnO4- K+NO3-Na+ | ||
| C. | K+Al3+Cl-SO42- | D. | Mg2+SO32-Br-Ba2+ |
7.下列有关实验操作的叙述,错误的是( )
| A. | 中和热的测定实验时,眼睛要注视温度计的刻度变化 | |
| B. | 萃取时,将混合物充分振荡后,需静置,待液体分层明显后才能分液 | |
| C. | 中和滴定实验时,为了使滴定终点的现象更加明显,可以滴加较多的指示剂 | |
| D. | 蒸馏时,温度计的读数刚达到某物质的沸点,不能立即收集馏出物 |
4.将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是( )
| A. | Na2CO3、Na2SiO3 | B. | Na2CO3、SiO2 | C. | Na2SiO3 | D. | SiO2 |
11.下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) | |
| B. | 物质的量浓度相等的①NH4HCO3溶液、②NH4Cl溶液、③NH4HSO4溶液中,c(NH4+)的大小关系:①>②>③ | |
| C. | 0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| D. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
1.下列离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O=2H++C1-+C1O- | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++4OH-=AlO2-+2H2O | |
| C. | FeS04溶液与稀硝酸反应:3Fe2++NO3-+4H+=3Fe3++NO+2H2O | |
| D. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
5.在c(Na+)为0.5mol•L-1的某溶液中,还可能含有下表中的若干离子.
取该溶液100mL进行如下实验(不考虑气体的溶解且气体体积是在标准状况下测定的).
试回答下列问题.
(1)由实验Ⅰ、Ⅱ可以得出的结论是原溶液中一定存在的离子有NH4+、CO32-、SO42-.
(2)实验Ⅱ中沉淀被溶解的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,Mg2+与CO32-不能大量共存的原因是Mg2++CO32-=MgCO3↓(用离子方程式表示).
(3)由实验Ⅲ得出原溶液中含有Cl-,你认为该观点是否正确?不正确(填“正确”或“不正确”),原因是步骤Ⅱ加入了氯离子.
(4)填写下表中各离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“×”)
(5)你认为原溶液中是否存在NO3-?不能确定(填“存在”、“不存在”或“不能确定”).原溶液中同时存在Cl-和NO3-,则c(NO3-)+c(Cl-)=0.4mol•L-1.
| 阳离子 | NH4+、Mg2+ |
| 阴离子 | Cl-、CO32-、SO42-、NO3- |
| 序号 | 实验内容 | 实验现象 |
| Ⅰ | 向该溶液中加入足量Ba(OH)2溶液并加热 | 产生6.27g白色沉淀并放出1.12L有刺激性气味的气体 |
| Ⅱ | 将Ⅰ得到的沉淀中滴加足量的稀盐酸 | 有气体放出,沉淀变为2.33g |
| Ⅲ | 向Ⅱ反应后的滤液中滴加AgNO3溶液 | 有白色沉淀产生 |
(1)由实验Ⅰ、Ⅱ可以得出的结论是原溶液中一定存在的离子有NH4+、CO32-、SO42-.
(2)实验Ⅱ中沉淀被溶解的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,Mg2+与CO32-不能大量共存的原因是Mg2++CO32-=MgCO3↓(用离子方程式表示).
(3)由实验Ⅲ得出原溶液中含有Cl-,你认为该观点是否正确?不正确(填“正确”或“不正确”),原因是步骤Ⅱ加入了氯离子.
(4)填写下表中各离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“×”)
| 阴离子 | NH4+ | Mg2+ | CO32- | SO42- |
| c/mol•L-1 | 0.5mol/L | × | 0.2mol/L | 0.1mol/L |
6.下列涉及无机化合物的分离提纯,其中说法正确的是( )
| A. | 除去CO2中混有的少量SO2,可将气体通过酸性高锰酸钾溶液 | |
| B. | 除去SiO2中混有的少量Al2O3,可以用NaOH溶液洗涤 | |
| C. | 除去Fe粉中的少量Mg粉,可以将该粉末用稀硝酸洗涤,然后过滤 | |
| D. | 除去NO2气体中混有的少量NO气体,可以向该气体中充入过量空气 |