题目内容
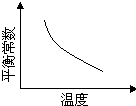
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2 N2O4△H<0)下列叙述正确的是
N2O4△H<0)下列叙述正确的是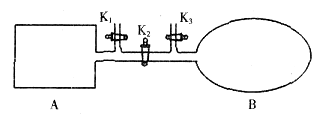
A. 到达平衡时A和B中NO2气体体积分数相同
B. 若在A、B中再充入与初始量相等的NO2,则达到平衡时A、B中NO2的转化率都增大
C. 若气球的体积不再改变,表明B中反应已达到平衡
D. 室温下,若设法使A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时B中气体的颜色较深
C
解析试题分析:根据装置可知,A是保持恒温恒容,B是保持恒温恒压。起始阶段A、B中NO2浓度相同,但平衡移动过程中A中由于NO2的量在减小,容器中压强也在减小,而B压强不变,到平衡时NO2气体体积分数不同,A选项错误;在加入等量的NO2气体,则A容器是相当于增大压强,平衡向正反应方向移动,转化率增大,B容器建立恒温恒压条件下的等效平衡,转化率不变,B选项错误;若气球的体积不再改变,则B容器中气体的物质的量不变,则达平衡;若A容器套上一个绝热层,则反应过程中本身的放热将用于体系的升温,导致A容器的温度高于B容器,A容器中到平衡时NO2的浓度更大,颜色更深,D错误,答案选C。
考点:考查可逆反应的有关计算以及外界条件对平衡状态的影响

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案常温下,0.2 mol·L-1的盐酸30mL分别与下列Na2CO3溶液混合,再加水稀释到100mL,其中最初产生CO2的速率最快的是
| A.20mL0.3 mol·L-1Na2CO3 | B.10mL0.4 mol·L-1Na2CO3 |
| C.25mL0.4 mol·L-1Na2CO3 | D.15mL0.5 mol·L-1Na2CO3 |
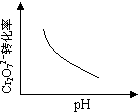
在K2CrO4的溶液中存在着如下的平衡:2CrO42- + 2H+ Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
| A.>7 | B.<7 | C.=7 | D.无法确定 |
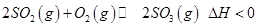 是制备硫酸的重要反应。下列说法正确的是
是制备硫酸的重要反应。下列说法正确的是
A.加入催化剂,反应速率加快,反应的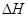 变大 变大 |
B.将平衡后的混合气体用浓硫酸吸收,剩余的气体只有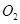 |
| C.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49% |
| D.若以稀硫酸为电解液,将该反应设计成原电池,放电过程中负极附近溶液的pH不断减小 |
下列有关说法正确的是
| A.25oC与60oC时,纯水的pH相等 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
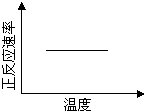
在一定温度下,反应A2(g) + B2(g) 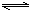 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
| A.单位时间内生成nmolA2同时生成nmolAB |
| B.容器内的总物质的量不随时间变化 |
| C.单位时间内生成2nmolAB的同时生成nmolB2 |
| D.单位时间内生成nmolA2的同时生成nmolB2 |
将氨基甲酸铵晶体置于特制的密闭真空容器中(假设容器体积不变,固体体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)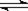 2NH3(g)+ CO2(g)。不能说明该分解反应达到平衡状态的是 ( )
2NH3(g)+ CO2(g)。不能说明该分解反应达到平衡状态的是 ( )

| A.单位时间内生成1 mol CO2的同时消耗2 mol NH3 |
| B.形成6个N—H键的同时有2个C=O键断裂 |
| C.容器中CO2与NH3的物质的量之比保持不变 |
| D.混合气体的密度不再改变的状态 |
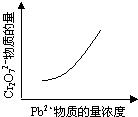
 B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是 2PbCrO4(s)+2H+(aq)△H<0
2PbCrO4(s)+2H+(aq)△H<0