题目内容
在K2CrO4的溶液中存在着如下的平衡:2CrO42- + 2H+ Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
| A.>7 | B.<7 | C.=7 | D.无法确定 |
A
解析试题分析:根据Cr原子守恒可知,当c(Cr2O72-)<10-5mol/L时,溶液中c(CrO42-)>(0.1mol/L-2×10-5mol/L)=0.1mol/L,因此根据平衡常数表达式可知此时溶液中c(H+)=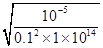 =10-8.5mol/L,所以所配溶液的pH>7,答案选A。
=10-8.5mol/L,所以所配溶液的pH>7,答案选A。
考点:考查pH计算

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
某温度下,将0.2 mol C(s)和0.3 mol H2O(g),投入2 L的密闭容器中,发生反应C(s)+H2O(g) CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
| A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1 |
| B.达平衡时压强变为原来的7/6 |
| C.此温度下该反应的平衡常数为0.005 |
| D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7% |
己知: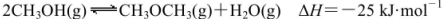 。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是
。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是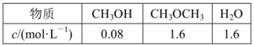
| A.此时刻反应达到平衡状态 |
| B.容器内压强不变时,说明反应达平衡状态 |
| C.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变 |
| D.平衡时,反应混合物的总能量降低40 kJ |
某温度下,对可逆反应2X(g) + Y(g) 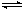 3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是
| A.加入少量W,逆反应速率增大,平衡向左移动 |
| B.增大压强,正反应速率增大,逆反应速率减小 |
| C.温度、体积不变,充入He气增大压强,反应速率会加快 |
| D.升高温度,混合气体的平均相对分子质量减小 |
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)  bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息判断,下列说法中正确的是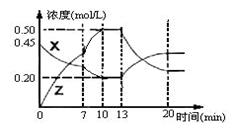
| A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min) |
| B.化学方程式中a:b= 1:3, |
| C.推测在第7min时曲线变化的原因可能是增加X的浓度 |
| D.推测该反应处于化学平衡状态的时间是10min--13min及第20min 后 |
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
| A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快 |
| B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
| C.“纳米铜”与铜是同素异形体 |
| D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快 |

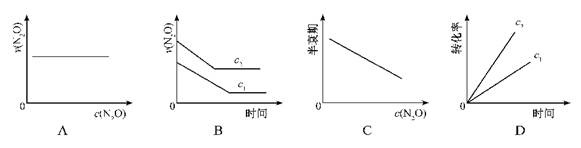 、
、 N2O4△H<0)下列叙述正确的是
N2O4△H<0)下列叙述正确的是
 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( )
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( )