题目内容
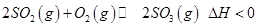 是制备硫酸的重要反应。下列说法正确的是
是制备硫酸的重要反应。下列说法正确的是
A.加入催化剂,反应速率加快,反应的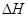 变大 变大 |
B.将平衡后的混合气体用浓硫酸吸收,剩余的气体只有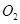 |
| C.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49% |
| D.若以稀硫酸为电解液,将该反应设计成原电池,放电过程中负极附近溶液的pH不断减小 |
D
解析试题分析:A、加入催化剂,反应速率加快,但反应热只与反应物和生成物的总能量有关,故△H不变,A错误;B、平衡混合物中除SO3和O2外还有SO2,浓硫酸只能吸收SO3,B错误;C、浓硫酸的密度大于水,故用等体积的水稀释后,溶液的质量小于原溶液的2倍,质量分数>原来的1/2,C错误;D、以该反应设计的原电池,负极上的反应为SO2变为SO3,SO3与水生成硫酸,使氢离子浓度升高,pH减小,D正确。
考点:考查化学反应速率、反应热、化学平衡、溶液的计算、电化学知识等内容。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
下列说法正确的是( )
| A.增大压强,活化分子数增加,化学反应速率一定增大 |
| B.升高温度,活化分子百分数增加,化学反应速率一定增大 |
| C.活化分子间所发生的分子间的碰撞为有效碰撞 |
| D.增大反应物浓度,使活化分子百分数增加,化学反应速率增大 |
某温度下,对可逆反应2X(g) + Y(g) 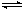 3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是
| A.加入少量W,逆反应速率增大,平衡向左移动 |
| B.增大压强,正反应速率增大,逆反应速率减小 |
| C.温度、体积不变,充入He气增大压强,反应速率会加快 |
| D.升高温度,混合气体的平均相对分子质量减小 |
对于反应aA+bB=dD+eE,该化学反应速率定义为 。式中
。式中 指物质
指物质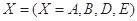 的反应速率,
的反应速率,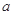 、
、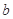 、
、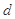 、
、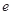 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
| 实验编号 | 1 | 2 | 3 | 4 |
| c(HI)/ mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 |
| c(H2O2)/ mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 |
| v/ mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 |
A.实验1、2中,
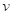 (H2O2)相等
(H2O2)相等B.将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合,反应开始时
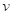 ="0.0304" mol·L-1·s-1
="0.0304" mol·L-1·s-1C.
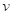 与“HI和H2O2浓度的乘积”的比值为常数
与“HI和H2O2浓度的乘积”的比值为常数D.实验4,反应5秒后H2O2浓度减少了0.0755 mol·L-1
下列关于化学反应速率的说法正确的是 ( )
| A.化学反应速率是指单位时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 |
| B.化学反应速率为0.8 mol /(L·s)是指1s 时某物质的浓度为0.8mol/L |
| C.根据化学反应速率的大小可以知道化学反应进行的快慢 |
| D.决定反应速率的主要因素是反应物的浓度 |
 N2O4△H<0)下列叙述正确的是
N2O4△H<0)下列叙述正确的是
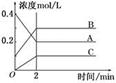
 2B(g)+C(g)
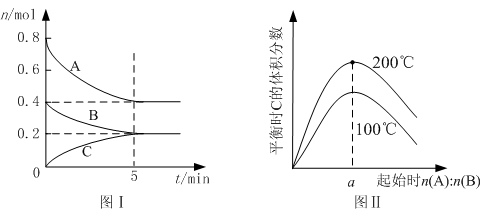
2B(g)+C(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是 ( )