题目内容
【题目】浓硫酸和铜在加热时反应,生成SO2气体的体积为3.36L(标准状况下)。已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。试计算:(写出计算过程)
CuSO4+SO2↑+2H2O。试计算:(写出计算过程)
(1)SO2气体的物质的量是多少?___
(2)参加反应的硫酸的物质的量是多少?___
(3)将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?___
【答案】0.15mol 0.3mol 0.3mol/L
【解析】
根据反应Cu+2H2SO4![]() CuSO4+SO2↑+2H2O中各物质的量关系进行计算,再结合溶液的体积计算硫酸铜的浓度。
CuSO4+SO2↑+2H2O中各物质的量关系进行计算,再结合溶液的体积计算硫酸铜的浓度。
标况下,3.36L二氧化硫的物质的量为![]() =0.15mol,
=0.15mol,
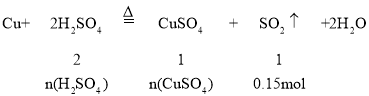
n(H2SO4)=2 n(SO2)=0.3mol,
n(CuSO4)=n(SO2)=0.15mol,
故生成的硫酸铜配制成500mL溶液,该溶液中CuSO4的物质的量浓度为![]() =0.3mol/L,
=0.3mol/L,
答:(1)SO2气体的物质的量是0.15mol;
(2)参加反应的硫酸的物质的量是0.3mol;
(3)溶液中CuSO4的物质的量浓度为0.3mol/L。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目