题目内容
【题目】Ⅰ.已知:①![]()
②![]()
③![]()
试据此写出一氧化碳燃烧的热化学方程式___________________________。
Ⅱ.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
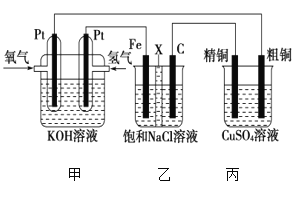
①石墨电极为________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液先变红。乙池中电解总方程式为____________。
②如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,溶液中硫酸铜浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为______________________。
③若在标准状况下,有224 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为________mL;丙装置中阴极析出铜的质量为________g。
【答案】2CO(g)+O2(g)= 2CO2(g) ΔH=-566 kJ/mol 阳极 铁极 2NaCl+2H2O![]() 2NaOH+H2+Cl2 减小 Cu2++2e-=Cu 448 1.28
2NaOH+H2+Cl2 减小 Cu2++2e-=Cu 448 1.28
【解析】
I.根据盖斯定律求解;
Ⅱ.根据图像可知,甲为氢氧碱性燃料电池,通入氢气的一极为负极,通入氧气的一极为正极;则乙、丙为电解池,粗铜、C与电源的正极相连为阳极,Fe、精铜为阴极。
Ⅰ.根据盖斯定律,(③-②)/2+①即可得到,CO(g)+![]() O2(g)=CO2(g)
O2(g)=CO2(g)![]() -393.5=-283kJ/mol;
-393.5=-283kJ/mol;
Ⅱ. ①分析可知,C为阳极;溶液中的氯离子失电子生成氯气,Fe电极水得电子生成氢气和氢氧根离子,则铁极区先变红,总反应式为2NaCl+2H2O![]() 2NaOH+H2
2NaOH+H2![]() +Cl2
+Cl2![]() ;
;
②粗铜电极反应式:Cu-2e-=Cu2+,Zn-2e-=Zn2+,阴极(精铜):Cu2++2e-=Cu,则溶液中的铜离子浓度减小;
③标准状况下,224 mL氧气,即0.01mol,化合价由0变为-2,转移0.04mol电子,则铁电极生成0.02mol氢气,即标况下为448mL;丙装置生成0.02molCu,即1.28g。

【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系________(填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为________(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=________mol·L-1。
(3)为减少SO2的排放,可用某些溶液洗涤含SO2的烟气。以下物质可做洗涤剂的是__________________________(填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO的化学方程式:_____________________________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__________________________。