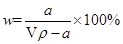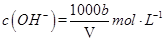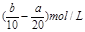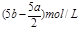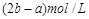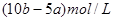题目内容
(8分)在m L b mol·L-1 AlCl3溶液中,加入等体积a mol·L-1的NaOH溶液。
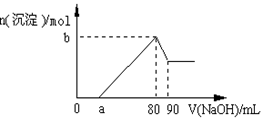
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量是___________mol。
(2)当a、b满足_____________条件时,无沉淀生成。
(3)当a、b满足________ ___条件时,有沉淀生成且溶液中无Al3+存在,生成Al(OH)3沉淀的物质的量是________ mol 。
。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量是___________mol。
(2)当a、b满足_____________条件时,无沉淀生成。
(3)当a、b满足________ ___条件时,有沉淀生成且溶液中无Al3+存在,生成Al(OH)3沉淀的物质的量是________ mol
 。
。31.(8分)(1)ma/3 (2)a≥4b (3)3b≤a<4b ,m(4b-a)
试题分析:分析本题时,写出AlCl3和NaOH反应的方程式,3NaOH+AlCl3=Al(OH)3+3NaCl、4NaOH+AlCl=NaAlO2+3NaCl+2H2O,然后利用铝离子和氢氧根离子以物质的量之比为1:3,恰好沉淀,1:4,沉淀恰好溶解,找出临界值把范围分为三部分进行讨论。
(1)在化学反应中,参加反应的物质的物质的量之比=化学计量数之比。AlCl3和NaOH反应,3NaOH+AlCl3=Al(OH)3+3NaCl,
当AlCl3和NaOH恰好反应即物质的量之比为1:3时,生成的Al(OH)3 物质的量最大.当a≤3b时,反应中NaOH不足量,计算时应以NaOH为标准进行,设生成Al(OH)3沉淀的物质的量为x。
3NaOH+AlCl3=Al(OH)3+3NaCl
3 1
m×a x
3:1=m×a:x
解得 x=ma/3 mol
(2)AlCl3和NaOH反应生成Al(OH)3,Al(OH)3是两性氢氧化物,能够溶于NaOH溶液,所以生成的沉淀会减少,NaOH+Al(OH)3=NaAlO2+2H2O,方程式3NaOH+AlCl3=Al(OH)3+3NaCl和 NaOH+Al(OH)3=NaAlO2+2H2O 相加,得到方程式4NaOH+AlCl=NaAlO2+3NaCl+2H2O,由方程式可得,当AlCl3和NaOH物质的量之比为1:4时,恰好没有沉淀产生.
4NaOH+AlCl=NaAlO2+3NaCl+2H2O
4 1
0.05a 0.05b
a:b=4:1
故答案为:a≥4b;
(3)有沉淀生成且溶液中无Al3+存在,先有沉淀生成,3NaOH+AlCl3=Al(OH)3+3NaCl,后又可能有部分沉淀溶解,NaOH+Al(OH)3=NaAlO2+2H2O,所以3b≤a<4b时,会出现有沉淀生成且溶液中无Al3+存在;当全部生成沉淀时,应以AlCl3为标准进行计算,当沉淀生成后又有部分沉淀溶解时,应以剩余的NaOH为标准进行计算。
设AlCl3全部转化为Al(OH)3时,需要的NaOH为xmol,生成的Al(OH)3为ymol,
3NaOH+AlCl3=Al(OH)3+3NaCl
3 1 1
x mb y
x=3mb y=mb
剩余NaOH的物质的量为:ma-3mb,
设生成NaAlO2时需要的Al(OH)3物质的量为zmol,
NaOH+Al(OH)3=NaAlO2+2H2O
1 1
ma-3mb z
z= ma-3mb
所以剩余的Al(OH)3物质的量为mb-(ma-3mb )=4mb-ma。
故答案为:3b≤a<4b;m(4b-a)。
点评:本题考查的是铝的重要化合物的有关计算及有关计算范围的讨论.在做讨论题时,结合有关化学方程式,找出反应的临界值进行讨论,简洁明了。如:NaOH溶液中通入CO2、向NaAlO2溶液中滴加稀盐酸等都是有关计算范围的讨论。

练习册系列答案
相关题目