题目内容
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变则( )
| A.反应过程中得到6.72 L的气体(标况) |
| B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C.最终得到的溶液中c(NaCl)=0.15 mol/L |
| D.最终得到7.8 g的沉淀 |
D
试题分析:15.6 g Na2O2和5.4 g Al的物质的量都是0.2mol,0.2mol过氧化钠可以生成0.1mol氧气和0.4mol氢氧化钠。0.2mol铝消耗0.2mol氢氧化钠生成0.3mol氢气,即气体是0.4mol为8.96L。6.72L氯化氢是0.3mol,其中0.2mol中和剩余的氢氧化钠,另外0.1mol和偏铝酸钠反应生成0.1mol氢氧化铝沉淀。此时溶液中还剩余0.1mol偏铝酸钠以及生成的0.3mol氯化钠,因此c(Na+)=c(Cl-)+c(OH-)+c(AlO2-),且溶液中NaCl的浓度为0.3mol÷0.2L=1.5mol/L。答案选D。
点评:本题用守恒法计算更简单。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
 )最大的是( )
)最大的是( ) 。
。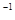 的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为()
的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为()