题目内容
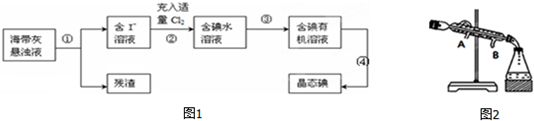
8. 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所示装置制备亚氯酸钠.
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所示装置制备亚氯酸钠.完成下列填空:
(1)组装好仪器后,检查装置气密性的操作是关闭分液漏斗的玻璃旋塞,将干燥管的末端浸末在水中,微热锥形瓶,干燥管末端有气泡产生,停止加热一段时间后,有回流的液柱,则气密性良好.
(2)装置①中用NaClO3、Na2SO3和浓H2SO4反应制得ClO2,写出该反应的化学方程式2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O,装置③发生反应的离子方程式为2ClO2+H2O2+2Na++2OH-+4H2O=2NaClO2•3H2O+O2↑.
(3)装置③反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:
①50℃左右蒸发结晶;
②趁热过滤;
③用50℃左右的温水洗涤;
④低于60℃干燥,得到成品.
步骤③中用50℃左右的温水洗涤的原因是防止产生NaClO2•3H2O晶体.
| 实验序号 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
②取25.00mL待测液,用2.0mol•L-1Na2S2O3标准液滴定(I2+2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为当滴入最后一滴Na2S2O3时,溶液由蓝色变为无色且半分钟内不变色.重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为90.5%.
(5)在实验过程中,下列操作会使实验结果偏高的是a、d
a.读取标准液体积时,开始时平视读数,结束时仰视读数
b.配制250mL待测液时,定容后摇匀发现液面下降,又补加水重新达到刻度线
c.盛装待测液的滴定管注液前未用待测溶液润洗
d.盛装标准液的滴定管尖嘴处滴定前有气泡,滴定终点时气泡消失
(6)已知常温下Ka(HClO2)=1×10-2、Ka(CH3COOH)=1.75×10-5,则0.1mol/L的HClO2溶液与0.05mol/L的NaOH溶液等体积混合所得溶液中各离子浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(H+)>c(OH-).
分析 (1)利用气体热胀冷缩、容器内外形成压强差检验气密性;
(2)在酸性条件下,NaClO3和Na2SO3溶液混合反应生成ClO2、Na2SO4和水;根据题意知,装置④反应后获得NaClO2晶体,即ClO2、NaOH和H2O2反应生成NaClO2•3H2O和O2;
(3)根据NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体;
(4)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;先根据数据的有效性求出消耗的Na2S2O3标准液体积的平均值,计算时一般找出关系式,由此进行计算,关系式为ClO2-~2I2~4S2O32-;
(5)a.根据c(待测)═$\frac{c(标准)×V(标准)}{V(待测)}$分析误差;
b.配制250mL待测液时,定容后摇匀发现液面下降,又补加水重新达到刻度线,溶液体积偏大,根据c=$\frac{n}{V}$分析误差;
c.根据c(待测)═$\frac{c(标准)×V(标准)}{V(待测)}$分析误差;
d.根据c(待测)═$\frac{c(标准)×V(标准)}{V(待测)}$分析误差;
(6)等浓度的CH3COOH与CH3COONa的混合溶液,CH3COOH的电离程度大于CH3COO-的水解程度,溶液呈酸性,由Ka(HClO2)=1×10-2、Ka(CH3COOH)=1.75×10-5可知,HClO2的酸性大于醋酸,所以等浓度的HClO2与NaClO2的混合溶液,HClO2的电离程度大于ClO2-离子的水解程度,溶液呈酸性,从而确定离子浓度大小.
解答 解:(1)组装好仪器后,检查整套装置气密性的操作是关闭分液漏斗的玻璃旋塞,将干燥管的末端浸末在水中,微热锥形瓶,干燥管末端有气泡产生,停止加热一段时间后,有回流的液柱,则气密性良好;
故答案为:关闭分液漏斗的玻璃旋塞,将干燥管的末端浸末在水中,微热锥形瓶,干燥管末端有气泡产生,停止加热一段时间后,有回流的液柱,则气密性良好;
(2)在酸性条件下,NaClO3和Na2SO3溶液混合反应生成ClO2、Na2SO4和水,反应为:2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O;装置④反应后获得NaClO2晶体,即ClO2、NaOH和H2O2反应生成NaClO2、H2O和O2,离子方程式为:2ClO2+H2O2+2Na++2OH-+4H2O=2NaClO2•3H2O+O2↑;
故答案为:2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O;2ClO2+H2O2+2Na++2OH-+4H2O=2NaClO2•3H2O+O2↑;
(3)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,所以为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥;
故答案为:趁热过滤;防止产生NaClO2•3H2O晶体;
(4)①以淀粉溶液做指示剂,碘单质遇淀粉变蓝色,反应结束时,碘反应完全,蓝色褪去,达到滴定终点时的现象为当滴加最后一滴Na2S2O3标准液时,溶液由蓝色变为无色且半分钟内不变色;
故答案为:当滴入最后一滴Na2S2O3时,溶液由蓝色变为无色且半分钟内不变色;
②滴定3次,消耗的1Na2S2O3标准液的体积分别为:19.96mL,20.04mL,23.40mL,第3组误差较大,舍去,两次测定的平均值为20.00mL,根据题给反应ClO2-+4I-+4H+=2H2O+2I2+C1-,I2+2S2O32-=2I-+S4O62-得关系式:ClO2-~2I2~4S2O32-,设样品中NaClO2的质量分数为x,则有:
ClO2-~4S2O32-
90.5g 4mol
10.0g•x 2mol•L-1×0.02L×10
解得:x=90.5%
故答案为:90.5%;
(5)a.读取标准液体积时,开始时平视读数,结束时仰视读数,V(标准)偏大,根据c(待测)═$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏高,故a正确;
b.配制250mL待测液时,定容后摇匀发现液面下降,又补加水重新达到刻度线,溶液体积偏大,根据c=$\frac{n}{V}$分析,可知所配制溶液的浓度偏小,故b错误;
c.盛装待测液的滴定管注液前未用待测溶液润洗,待测液浓度偏小,其溶质的物质的量偏小,V(标准)偏小,根据c(待测)═$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏低,故c错误;
d.盛装标准液的滴定管尖嘴处滴定前有气泡,滴定终点时气泡消失,V(标准)偏大,根据c(待测)═$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏高,故d正确;
故选:a、d;
(6)0.1mol/L的HClO2溶液与0.05mol/L的NaOH溶液等体积混合,两者反应生成0.025mol/LNaClO2,同时剩余0.025mol/HClO2,等浓度的CH3COOH与CH3COONa的混合溶液,CH3COOH的电离程度大于CH3COO-的水解程度,溶液呈酸性,由Ka(HClO2)=1×10-2,Ka(CH3COOH)=1.75×10-5可知,HClO2的酸性大于醋酸,所以等浓度的HClO2与NaClO2的混合溶液,HClO2的电离程度大于ClO2-离子的水解程度,溶液呈酸性,溶液中离子浓度大小为:c(ClO2-)>c(Na+)>c(H+)>c(OH-);
故答案为:c(ClO2-)>c(Na+)>c(H+)>c(OH-).
点评 本题考查物质的制备、对信息的利用、对装置的理解、氧化还原反应滴定等,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大,注意氧化还原反应滴定中利用关系式进行的计算.

| A. | ④①②③ | B. | ④②①③ | C. | ②④①③ | D. | ④①③② |
| A. | R一定是一种盐 | B. | R一定是一种强碱 | ||
| C. | R一定是离子化合物 | D. | R可能是强酸 |
| A. | 混合气体的密度 | B. | 气体B、C的物质的量浓度之比 | ||
| C. | 气体B、D的质量之比 | D. | 气体C、D的物质的量之比 |
| A. | ClO3-的空间构型为平面三角形 | |
| B. | SiF4 和 SO32-的中心原子均为 sp3 杂化 | |
| C. | 在所有的元素中,氟的第一电离能最大 | |
| D. | C2H5OH 分子中共含有 8 个极性键,1 个 π 键 |
| A. | c(H+) | B. | H+个数 | C. | CH3COOH分子数 | D. | c(H+)/c(CH3COOH) |