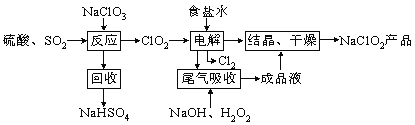
题目内容
【题目】车用妄全气囊中反应方程式为NaN3=2Na+3N2↑,用双桥线标出电子转移的数目和变化类型,指出氧化剂和还原剂。若要得到标准状况下33.6 LN2,需要多少克NaN3(写出计算过程),NaN3的密度约为2 g/cm3,则NaN3的体积约为多少立方厘米。
【答案】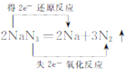
需要NaN3的质量为75g,体积为37.5 cm3。
【解析】
试题分析:NaN3中的钠元素由+1价降为0价,化合价降低,被还原,NaN3为氧化剂,Na为还原产物;NaN3中的氮元素由-1价升高为0价,化合价升高,被氧化,NaN3为还原剂,N2为氧化产物。据此用双线桥标出电子转移的方向与数目为: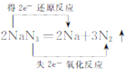 。
。
为了求需要NaN3的质量,需要利用化学方程式进行计算。
设需要NaN3的质量为x,则:
2NaN3=2Na+3N2↑
130g 3×22.4L
x 33.6L
则![]() ,解得:x=75g;
,解得:x=75g;
由于NaN3的密度约为2 g/cm3,则体积![]() ;
;
故需要NaN3的质量为75g,体积为37.5 cm3。

【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X元素在周期表中的位置为 ,表中元素原子半径最小的是_________(填元素名称)。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
a. Y单质与H2S溶液反应,溶液变浑浊
b. 在氧化还原反应中,1molY单质比1molS得电子多
c. Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)表中某元素的气态氢化物与该元素的最高价氧化物对应的水化物可以反应,写出该反应的化学方程式为 。
(4)向盛有少量氢硫酸溶液的试管中通入二氧化硫气体,在实验结束后发现试管内壁上沾有黄色粉末,则清洗该试管的方法是 。
(5)已知元素Na与元素Y可形成原子个数比为1:1的二元离子化合物,写出该化合物的电子式 ,该化合物中的化学键类型有 。
(6)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式 。