题目内容
10.常温下,PH都等于5的盐酸、醋酸、氯化铵溶液中,水的电离度分别为a1、a2、a3,则他们的关系是( )| A. | a1=a2>a3 | B. | a1>a2>a3 | C. | a1=a2<a3 | D. | a1<a2<a3 |
分析 酸和碱能抑制水的电离,而盐的水解能促进水的电离,据此分析.
解答 解:酸能抑制水的电离,常温下,PH都等于5的盐酸、醋酸溶液中,氢离子浓度均为10-5mol/L,对水的电离的抑制程度相同,故两溶液中水的电离程度相同,即a1=a2;
而盐的水解能促进水的电离,故在氯化铵溶液中,水的电离程度a3>a1=a2,故选C.
点评 本题考查了酸、碱和能水解的盐对水的电离程度的影响,难度不大,根据酸和碱能抑制水的电离,而盐的水解能促进水的电离来分析.

练习册系列答案
相关题目
20.在酸性的无色透明溶液中能够大量共存的是( )
| A. | NH${\;}_{4}^{+}$、Fe3+、SO42-、Cl- | B. | Mg2+、Ag+、CO32-、Cl- | ||
| C. | K+、NH4+、Cl-、SO42- | D. | K+、Na+、NO3-、HCO3- |
1.高铁酸钾(K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH═2K2FeO4+3KCl+5H2O,下列说法正确的是( )
| A. | 反应中 KClO做还原剂 | |
| B. | KCl是还原产物 | |
| C. | K2FeO4中铁的化合价为+7 | |
| D. | 制备K2FeO4时,1 molFe(OH)3得到3 mol电子 |
18.下列解释过程或事实的方程式不正确的是( )
| A. | 向Na2SO3、NaI的混合溶液中滴加少量氯水:2I-+C12═2Cl-+I2 | |
| B. | 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaSiO3+H2O | |
| C. | 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| D. | 漂白粉和“洁厕灵”(主要成分浓盐酸)混合使用放出氯气:ClO-+Cl-+2H+═Cl2↑+H2O |
5.美国UNC化学教授Thomas J.Meyer等研发了环境友好、完全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物.已知10mL Na2R溶液含Na+的数目为N,该Na2R溶液的物质的量浓度为( )
| A. | N×10-2mol•L-1 | B. | $\frac{N}{1.024×1{0}^{22}}$mol•L-1 | ||
| C. | $\frac{N}{6.02×1{0}^{21}}$mol•L-1 | D. | $\frac{N}{6.02×1{0}^{25}}$mol•L-1 |
15.一般情况下,前者无法决定后者的是( )
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 化合物熔融状态是否导电--化合物是否为离子化合物 | |
| C. | 分子间作用力的大小--分子稳定性的强弱 | |
| D. | 物质内部储存的能量高低--化学反应的热效应 |
2.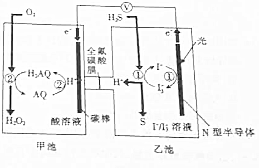 我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2─H2O2+S↓.
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2─H2O2+S↓.
已知甲池中发生的反应为: 下列说法正确的是( )
下列说法正确的是( )
 我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2─H2O2+S↓.
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2─H2O2+S↓.已知甲池中发生的反应为:
 下列说法正确的是( )
下列说法正确的是( )| A. | 该装置将电能转化为光能 | |
| B. | H+从甲池移向乙池 | |
| C. | 甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ | |
| D. | 乙池溶液中发生的反应为H2S+I3-═3I-+S↓+2H+ |