题目内容
【题目】甲、乙两个实验小组利用![]() 酸性溶液与
酸性溶液与![]() 溶液反应研究影响反应速率的因素。
溶液反应研究影响反应速率的因素。
设计实验方案如下![]() 实验中所用
实验中所用![]() 溶液均已加入
溶液均已加入![]() :
:
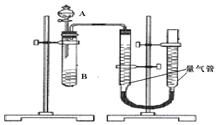
甲组:通过测定单位时间内生成![]() 气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
序号 | A溶液 | B溶液 |
① |
|
|
② |
|
|
③ |
|
|
![]() 该反应的离子方程式为 ______
该反应的离子方程式为 ______
![]() 实验开始前需要检查气密性.分液漏斗中A溶液应该 ______ 加入
实验开始前需要检查气密性.分液漏斗中A溶液应该 ______ 加入![]() 填“一次性”或“逐滴滴加”
填“一次性”或“逐滴滴加”![]()
![]() 完成该实验还需要 ______
完成该实验还需要 ______ ![]() 填仪器名称
填仪器名称![]() ,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定![]() 溶液褪色所需时间的多少来比较化学反应速率为了探究
溶液褪色所需时间的多少来比较化学反应速率为了探究![]() 与
与![]() 浓度对反应速率的影响,某同学在室温下完成以下实验
浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水 | 10 | 5 | 0 | X |
| 5 | 10 | 10 | 5 |
| 5 | 5 | 10 | 10 |
时间 | 40 | 20 | 10 | --- |
![]() ______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 ______ 。
______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 ______ 。
![]() 号反应中,
号反应中,![]() 的反应速率为 ______。
的反应速率为 ______。
![]() 在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
温度℃ | 25 | 26 | 26 | 26 |
| 27 | 27 |
结合实验目的与表中数据,你得出的结论是 ______。
![]() 从影响化学反应速率的因素看,你的猜想还可能是 ______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 ______
从影响化学反应速率的因素看,你的猜想还可能是 ______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 ______ ![]() 填字母
填字母![]() 。
。
A 硫酸钾![]() 水
水![]() 二氧化锰
二氧化锰![]() 硫酸锰。
硫酸锰。
【答案】![]() 一次性 秒表
一次性 秒表![]() 或计时器
或计时器![]()
![]()
![]() 过量
过量 ![]() 温度不是反应速率突然加快的原因 催化剂 D
温度不是反应速率突然加快的原因 催化剂 D
【解析】
(1)KMnO4酸性溶液与H2C2O4溶液反应生成二氧化碳、硫酸锰和水;
(2)无论避免影响测定结果,分液漏斗中的A溶液不能逐滴加入;
(3)判断反应速率需要时间,用秒表计时;
(4)探究浓度对反应速率的影响时,溶液的总体积都为20mL,据此判断X值;由于4号实验中高锰酸钾过量,则溶液没有褪色;
(5)根据n=cV计算出反应物的物质的量,然后根据不足量计算出反应消耗的草酸的物质的量,最后根据![]() 计算出H2C2O4的反应速率;
计算出H2C2O4的反应速率;
(6)根据表中数据知,20s时温度不最高,但20s前突然褪色;
(7)考虑锰离子有催化作用,要想验证锰离子的催化作用,再加入硫酸锰即可。
![]() 酸性溶液与
酸性溶液与![]() 溶液反应生成二氧化碳、硫酸锰和水,该反应的离子方程式为:
溶液反应生成二氧化碳、硫酸锰和水,该反应的离子方程式为:![]() ;
;
故答案为:![]() ;
;
![]() 为了避免实验误差,实验过程中分液漏斗中的溶液A必须一次性加入,不能逐滴加入;
为了避免实验误差,实验过程中分液漏斗中的溶液A必须一次性加入,不能逐滴加入;
故答案为:一次性;
![]() 根据反应速率
根据反应速率![]() 可知,需要测定时间从而判断反应速率大小,需要用秒表
可知,需要测定时间从而判断反应速率大小,需要用秒表![]() 或计时器
或计时器![]() 计时;
计时;
故答案为:秒表![]() 或计时器
或计时器![]() ;
;
![]() 为了探究
为了探究![]() 与
与![]() 浓度对反应速率的影响,实验
浓度对反应速率的影响,实验![]() 中溶液的总体积应该为20,则
中溶液的总体积应该为20,则![]() ;根据反应
;根据反应![]() 可知,10mL酸性高锰酸钾需要消耗10mL草酸溶液,所以实验4中高锰酸钾过量,导致溶液没有褪色;
可知,10mL酸性高锰酸钾需要消耗10mL草酸溶液,所以实验4中高锰酸钾过量,导致溶液没有褪色;
故答案为:5;![]() 溶液过量;
溶液过量;
![]() 号实验中草酸的物质的量为:
号实验中草酸的物质的量为:![]() ,高锰酸钾的物质的量为:
,高锰酸钾的物质的量为:![]() ;根据反应
;根据反应![]() 可知,高锰酸钾不足,所以反应中消耗的草酸的物质的量为:
可知,高锰酸钾不足,所以反应中消耗的草酸的物质的量为:![]() ,2号反应中,
,2号反应中,![]() 的反应速率为:
的反应速率为: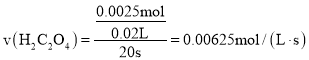 ;
;
故答案为:![]() ;
;
![]() 根据表中数据知,20s时温度不最高,但20s前突然褪色,说明温度不是反应速率突然加快的原因;
根据表中数据知,20s时温度不最高,但20s前突然褪色,说明温度不是反应速率突然加快的原因;
故答案为:温度不是反应速率突然加快的原因;
![]() 与
与![]() 反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可,故选D;
反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可,故选D;
故答案为:催化剂;D。

【题目】在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min | 2 | 4 | 7 | 9 |
n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前4min的平均反应速率υ(Z)=0.0125molL-1min-1
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C. 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大
D. 该温度下此反应的平衡常数K=1.44
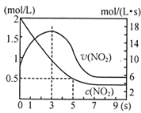
【题目】在100℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为__________mol·L1·s1。
(2)n3________(填“>”“<”或“=”)n4;该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L1。
(4)上述(3)达到平衡后N2O4的转化率为______________,混合气体的平均摩尔质量为______________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2N2O4的平衡常数将_______________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将______________(填“向左移动”“向右移动”或“不移动”)。