题目内容
现有反应:CO(g)+H2O(g) 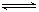 CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
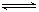 CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )A.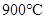 ,该反应的平衡常数 ,该反应的平衡常数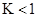 |
B.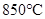 达到平衡时,通入CO,CO转化率将增大 达到平衡时,通入CO,CO转化率将增大 |
C.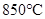 时,若 时,若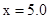 ,则起始时平衡向逆反应方向移动 ,则起始时平衡向逆反应方向移动 |
D.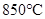 时,若要使上述反应开始时向正反应方向进行,则 时,若要使上述反应开始时向正反应方向进行,则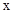 应满足 应满足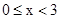 |
B
试题分析:正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,A正确;增大CO的浓度,平衡向正反应方向移动,水蒸气的转化率增大,但CO的转化率降低,B不正确;根据
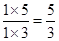 >1,所以反应向逆反应方向移动,C正确;要使反应向正反应方向进行,则
>1,所以反应向逆反应方向移动,C正确;要使反应向正反应方向进行,则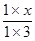 <1,解得0≤x<3,所以选项D正确,答案选B。
<1,解得0≤x<3,所以选项D正确,答案选B。点评:化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据平衡常数可以判断反应进行的程度以及判断反应进行的方向。

练习册系列答案
相关题目
 pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时,能说明达到平衡状态的标志是( )
pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时,能说明达到平衡状态的标志是( ) 2NH3(g),能说明反应已达到平衡状态的是:( )
2NH3(g),能说明反应已达到平衡状态的是:( )  2NH3(g),不能作为反应达到平衡状态的判断依据是( )
2NH3(g),不能作为反应达到平衡状态的判断依据是( ) C(g)达到平衡时,C的体积分数为40%。试回答有关问题。
C(g)达到平衡时,C的体积分数为40%。试回答有关问题。 CH3OH(g).
CH3OH(g).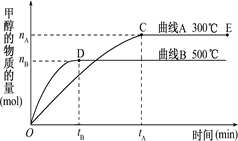
 N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( )
N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( )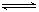 N2O4;△H<O,在密闭容器中达到平衡。平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变大了,则改变条件的可能有
N2O4;△H<O,在密闭容器中达到平衡。平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变大了,则改变条件的可能有 达到平衡的标志的是:
达到平衡的标志的是: