题目内容
对于N2(g)+3H2(g)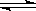 2NH3(g),不能作为反应达到平衡状态的判断依据是( )
2NH3(g),不能作为反应达到平衡状态的判断依据是( )
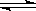 2NH3(g),不能作为反应达到平衡状态的判断依据是( )
2NH3(g),不能作为反应达到平衡状态的判断依据是( )| A.恒容密闭容器中总压强不变 | B.恒容密闭容器中混合气体的密度不变 |
| C.生成氨气的速率与氨气分解的速率相等 | D.N2、H2、NH3的浓度不再发生变化 |
AB
试题分析:可逆反应达到化学平衡状态的标志是正、逆反应速率相等、各组分浓度保持不变。反应正向进行时气体物质的量减小,定温、恒容密闭容器中气体的压强减小,所以压强不变不能说明反应达到平衡状态,需加定温条件,A错误;恒容密闭容器中气体体积不变,反应前后都是气体,所以气体的质量守恒,无论是平衡态还是非平衡态,气体的密度均不变,B错误;生成氨气的速率与氨气分解的速率相等即v(正)=v(逆),C是平衡状态;各组分浓度保持不变,说明反应达到平衡状态,D正确。
点评:理解化学平衡状态的直接标志(正、逆反应速率相等、各组分浓度保持不变)和间接标志(体系的压强、温度、颜色、平均摩尔质量等),但一定要分析清楚。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
 2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示:
2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示: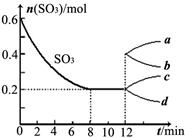
 C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为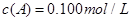 、
、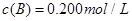 及
及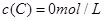 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。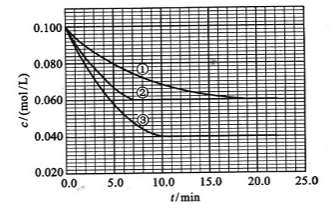
 cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。
cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。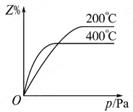
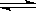 2SO3(g)达到平衡时,平衡气体中SO3的体积分数为91%。试回答下列问题:
2SO3(g)达到平衡时,平衡气体中SO3的体积分数为91%。试回答下列问题: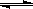 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: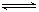 CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )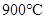 ,该反应的平衡常数
,该反应的平衡常数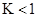
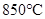 达到平衡时,通入CO,CO转化率将增大
达到平衡时,通入CO,CO转化率将增大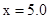 ,则起始时平衡向逆反应方向移动
,则起始时平衡向逆反应方向移动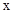 应满足
应满足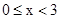
 2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。
2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。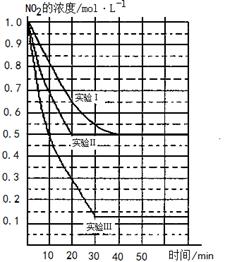
 SO3(g)+NO(g) △H>0,将NO2与SO2以体积比
SO3(g)+NO(g) △H>0,将NO2与SO2以体积比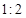 置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。 2C(g),可以判断达到化学平衡状态的是
2C(g),可以判断达到化学平衡状态的是