题目内容
16.有机化学中的反应类型较多,将下列反应归类(填序号).①由乙炔制氯乙烯 ②乙烷在空气中燃烧
③乙烯使溴的四氯化碳溶液褪色 ④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯 ⑥甲烷与氯气在光照的条件下反应
⑦溴乙烷和氢氧化钠的乙醇溶液共热 ⑧由甲苯制取TNT
⑨乙苯的制备:

(1)其中属于取代反应的是⑥⑧;属于氧化反应的是②④;属于加成反应的是①③⑨;属消去反应的是⑦; 属于聚合反应的是⑤.
(2)写出⑦和⑧的化学方程式:⑦
 ⑧
⑧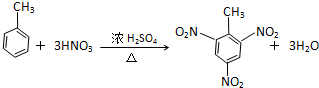 .
.
分析 (1)取代反应是有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应;
氧化反应是物质所含元素化合价升高的反应;
加成反应是有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应;
消去反应是指在一定条件下,有机物脱去小分子生成含有不饱和的有机物的反应;
聚合反应是由单体合成聚合物的反应过程;
(2)溴乙烷和氢氧化钠乙醇溶液共热,生成乙烯;苯与乙烯发生加成反应生成乙苯.
解答 解:(1):①由乙炔制氯乙烯,是乙炔中的三键断裂,每个碳原子上分别结合一个氢原子和氯原子生成氯乙烯,属于加成反应;
②乙烷在空气中燃烧,是乙烯被氧气氧化生成了二氧花碳,化合价升高,属于氧化反应;
③乙烯使溴的四氯化碳溶液褪色,是乙烯中的双键断裂,每个碳原子上结合一个溴原子生成1,2-二溴乙烯,属于加成反应;
④乙烯使酸性高锰酸钾溶液褪色,是乙烯被高锰酸钾氧化生成了二氧花碳,化合价升高,属于氧化反应;
⑤由乙烯制聚乙烯,是单体乙烯通过加聚生成聚乙烯,属于聚合反应;
⑥甲烷与氯气在光照的条件下反应,是甲烷中的氢原子被氯原子所代替生成氯代物而使黄绿色消失,属于取代反应;
⑦溴乙烷和氢氧化钠乙醇溶液共热,生成乙烯,属于消去反应;
⑧甲苯制取TNT,苯环上的H被硝基取代,属于取代反应;
⑨苯与乙烯发生加成反应生成乙苯;
故答案为:⑥⑧;②④;①③⑨;⑦;⑤;
(2溴乙烷和氢氧化钠乙醇溶液共热,生成乙烯;苯与乙烯发生加成反应生成乙苯.化学方程式: ;
; ,故答案为:
,故答案为: ;
; .
.
点评 本题考查有机物的结构与性质,侧重有机反应类型的考查,题目难度中等.

练习册系列答案
相关题目
7.下列实验操作和对应的现象、结论都正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将足量的乙烯通入到溴水中 | 溴水褪色 | 乙烯与溴水反应生成无色物质 |
| B | 往CaCl2溶液中通入足量的CO2 | 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C | 将铜板电路投入FeCl3溶液中 | 铜溶于FeCl3溶液 | 氧化性:Fe3+>Cu2+ |
| D | 取久置的Na2O2粉末,向其中滴加足量的盐酸 | 产生无色气体 | Na2O2已变质为Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
11.燃烧0.1mol 两种气态烃的混合物,生成3.58L CO2(标准状况)和3.60g H2O,则混合气体中( )
| A. | 一定有甲烷 | B. | 一定有乙烷 | C. | 一定无甲烷 | D. | 可能有乙烯 |
1.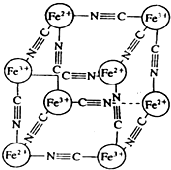 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )| A. | 该晶体是离子晶体 | |
| B. | M的离子位于上述晶胞面心,呈+2价 | |
| C. | 晶体的化学式可表示为MFe2(CN)6,且M为+1价 | |
| D. | M的离子位于上述晶胞体心,呈+2价 |
2.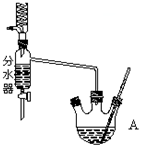 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
操作如下:
①在50mL三颈烧瓶中投入几粒沸石,将18.5mL正丁醇和13.4mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥.
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式CH3CH2CH(OH)CH3.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(3)步骤 ①向三颈烧瓶中依次加入的药品是:正丁醇,浓硫酸,冰醋酸.
(4)步骤 ②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是除去酯中混有的乙酸和正丁醇.
(5)步骤 ③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高,(填“高”或“低”)原因是会收集到少量未反应的冰醋酸和正丁醇
(6)该实验生成的乙酸正丁酯的产率是65%.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL三颈烧瓶中投入几粒沸石,将18.5mL正丁醇和13.4mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥.
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式CH3CH2CH(OH)CH3.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(3)步骤 ①向三颈烧瓶中依次加入的药品是:正丁醇,浓硫酸,冰醋酸.
(4)步骤 ②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是除去酯中混有的乙酸和正丁醇.
(5)步骤 ③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高,(填“高”或“低”)原因是会收集到少量未反应的冰醋酸和正丁醇
(6)该实验生成的乙酸正丁酯的产率是65%.
3.区分强弱电解质的标准是( )
| A. | 在水中的溶解度 | B. | 溶液的导电能力 | ||
| C. | 在水中的电离程度 | D. | 化学键的类型 |
 1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量
1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量 燃烧的热化学方程式为2H2(g)+O2(g)==2H2O(l) ΔH=-285.8 kJ·mol-1
燃烧的热化学方程式为2H2(g)+O2(g)==2H2O(l) ΔH=-285.8 kJ·mol-1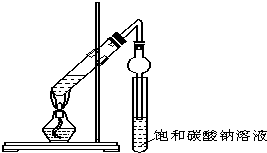 某同学用下图所示实验装置制取乙酸乙酯.回答以下问题:
某同学用下图所示实验装置制取乙酸乙酯.回答以下问题: