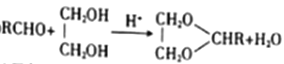
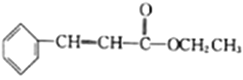
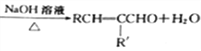题目内容
【题目】下列叙述正确的是
A. 物质的量浓度为0.5 mol/L的MgCl2溶液,含有Cl- 个数为NA
B. V mL硫酸铁溶液中含有mg SO42-,则Fe3+的物质的量浓度为6.94m/V mol·L-1
C. 将58.5 g NaCl溶解于1 L水中配成溶液,所得溶液的物质的量浓度为1 mol·L-1
D. 18g H2O含有8NA个质子
【答案】B
【解析】
A.溶液体积未知,不能计算氯离子数目,A错误;
B.硫酸根的物质的量为m/96 mol,不考虑水的电离,溶液中3n(Fe3+)=2n(SO42-),则n(Fe3+)=m/144 mol,故Fe3+的物质的量浓度为![]() ,B正确;
,B正确;
C.58.5 g NaCl为1mol,溶解于水中配成1L溶液,所得溶液浓度为1mol/L,体积1L为溶液的体积,不是溶剂的体积,C错误;
D.18g H2O的物质的量是1mol,含有10NA个质子,D错误。
答案选B。

【题目】在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,发生反应:N2O4(g)![]() 2NO2(g)。隔一定时间对该容器内物质的浓度进行分析得到如表数据。回答有关问题;
2NO2(g)。隔一定时间对该容器内物质的浓度进行分析得到如表数据。回答有关问题;
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
①c3________c4(填“>”、“<”或“=”)。
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为_________mol·L-1·s-1。
③达平衡后下列条件的改变可使NO2气体浓度增大的是_______(填序号)。
A.扩大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
④若在相同条件下,起始时只充入0.200 mol NO2气体,则达到平衡时NO2气体的转化率为_________。