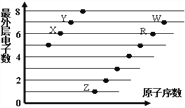
题目内容
【题目】在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是( )
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
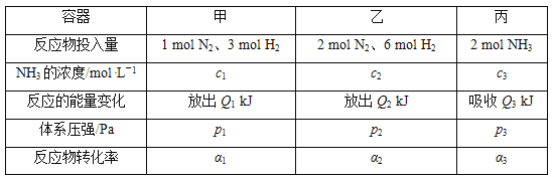
A. 2p1=2p3<p2
B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1
D. Q1+Q3=92.4
【答案】D
【解析】甲容器投入1 mol N2、3 mol H2,丙容器投入2 mol NH3,恒温恒容条件下,甲容器与丙容器是等效平衡,各组分的物质的量、百分含量、转化率等完全相等;而甲容器投入1 mol N2、3 mol H2,乙容器投入2 mol N2、6 mol H2,乙中投入量是甲中的2倍,如果恒温且乙容器容积是甲容器的2倍,则甲容器与乙容器为等效平衡,所以乙所到达的平衡,可以看作在恒温且容积是甲容器2倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所达到的平衡,由于该反应是气体体积减小的反应,缩小容器体积,相当于增大压强,平衡正向移动,所以乙中氮气、氢气转化率大于甲和丙的,平衡后乙中氨气含量最高,因此B错误;A项,由上述分析知,甲与丙为等效平衡,p1=p3,乙中投料量为甲的2倍,恒温恒容下,乙中相当于增大压强,平衡向正反应方向移动,所以乙中压强减小,小于甲的2倍,即2p1=2p3>p2,错误;C项,丙容器中加入2 mol NH3,最后达到和甲相同的平衡状态,若平衡不移动,则转化率α1+α3=1;乙容器投入2 mol N2、6 mol H2,相当于增大压强,平衡正向移动,α2增大,所以转化率α2+α3>1,错误;D项,甲中投入1 mol N2、3 mol H2,丙中投入2 mol NH3,则甲与丙是完全等效的,根据盖斯定律可知,甲与丙的反应的能量变化之和为92.4 kJ,故Q1+Q3=92.4,正确。答案选D。

 名校课堂系列答案
名校课堂系列答案