题目内容
【题目】在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,发生反应:N2O4(g)![]() 2NO2(g)。隔一定时间对该容器内物质的浓度进行分析得到如表数据。回答有关问题;
2NO2(g)。隔一定时间对该容器内物质的浓度进行分析得到如表数据。回答有关问题;
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
①c3________c4(填“>”、“<”或“=”)。
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为_________mol·L-1·s-1。
③达平衡后下列条件的改变可使NO2气体浓度增大的是_______(填序号)。
A.扩大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
④若在相同条件下,起始时只充入0.200 mol NO2气体,则达到平衡时NO2气体的转化率为_________。
【答案】 = 0.001 B 25%
【解析】(1)由表可以知道,![]() 时反应达平衡,此时c(NO2)= 0.120mol·L-1,c(N2O4)= c3mol·L-1,相同温度下,到80s时c(NO2)= 0.120mol·L-1,c(N2O4)= c4 mol·L-1,所以①c3=c4。答案:= 。
时反应达平衡,此时c(NO2)= 0.120mol·L-1,c(N2O4)= c3mol·L-1,相同温度下,到80s时c(NO2)= 0.120mol·L-1,c(N2O4)= c4 mol·L-1,所以①c3=c4。答案:= 。
②在上述条件下,从反应开始直至达到化学平衡时,
N2O4(g) ![]() 2NO2(g)。
2NO2(g)。
初始量 0.100mol/L 0
变化量 0.06 mol/L 0.120mol·L-1
N2O4的平均反应速率为=0.06 mol/L![]() 60S= 0.001 mol·L-1·s-1。答案:0.001
60S= 0.001 mol·L-1·s-1。答案:0.001
③N2O4(g) ![]() 2NO2(g)反应是气体体积减小的放热反应,根据化学平衡原理分析选项,增大二氧化氮浓度的条件;A、增大容器体积,各组分浓度均减小,故A错误;B、再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,所以B选项是正确的;C、减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;D、再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;所以B选项是正确的。
2NO2(g)反应是气体体积减小的放热反应,根据化学平衡原理分析选项,增大二氧化氮浓度的条件;A、增大容器体积,各组分浓度均减小,故A错误;B、再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,所以B选项是正确的;C、减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;D、再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;所以B选项是正确的。
④根据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4(g) ![]() 2NO2(g)
2NO2(g)
起始量![]() 0
0
变化量![]() 0.12
0.12
平衡量![]() 0.12
0.12![]()
若起始时充入0.200 mol/L NO2气体,设消耗二氧化氮物质的量浓度为x,
2NO2(g) ![]() N2O4(g) K=1/0.36,
N2O4(g) K=1/0.36,
起始量 0.200 mol/L 0
变化量 x 0.5x
平衡量 0.200 –x 0.5x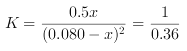 k=0.5x/(0.200 –x)2=1/0.36,
k=0.5x/(0.200 –x)2=1/0.36,
x=0.05 mol/L
则达到平衡时NO2气体的转化率0.05 mol/L /0.2 mol/L ![]() 100%=25%,
100%=25%,
因此,本题正确答案是: 25%.

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示。
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示。
t ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_______________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质平衡浓度符合:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____________移动(填“向正反应方向”“向逆反应方向”或“不”)。
(5)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为____(填“正反应方向”“逆反应方向”或“不移动”)。