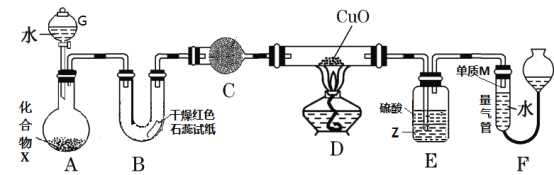
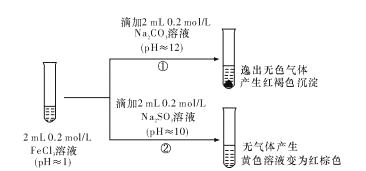
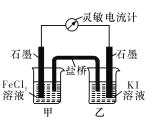
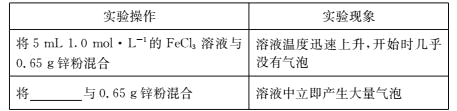
题目内容
【题目】对于反应2HI(g)![]() H2(g)+I2(g,紫色),下列叙述能够说明已达平衡状态的是( )
H2(g)+I2(g,紫色),下列叙述能够说明已达平衡状态的是( )
A. 混合气体的质量不再变化
B. 温度和体积一定时,容器内压强不再变化
C. 1molH-H键断裂的同时有2molH-I键断裂
D. 各物质的物质的量浓度之比为2∶1∶1
【答案】C
【解析】
A.根据反应可知,反应物、生成物全部为气体,气体的质量在反应前后不发生变化,无法判断是否达到平衡状态,故A错误;
B.反应两边气体的体积不变,反应过程中压强始终不变,所以容器内压强不再变化,无法判断是否达到平衡状态,故B错误;
C.1molH-H键断裂体现正反应,断裂2molH-I键体现逆反应,正逆反应的速率之比等于化学计量数之比,说明正逆反应速率相等,反应达到平衡状态,故C正确;
D.由于反应起始的各物质的量没有给出,因此平衡状态时各物质的物质的量浓度之比不确定,不能证明反应达到平衡状态,故D错误。
故选C。

【题目】如下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧的元素符号是________(填写元素符号)。
(2)表中金属性最强的元素是____(填元素符号),该元素在周期表中的位置是_______。
(3)写出①、③、④最高价氧化物对应的水化物两两反应的化学方程式
_________________________________
_________________________________
_________________________________
(4)请设计一个实验方案,比较⑦、⑧非金属性的强弱(用化学方程式表示):_______。
(5)③、⑦两种元素形成的化合物的电子式为_____,⑦的气态氢化物的电子式为_______。