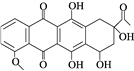
题目内容
【题目】如图是s能级和p能级的原子轨道图,试回答下列问题:
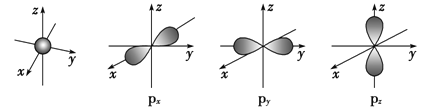
(1)s电子的原子轨道呈______形,每个s能级有______个原子轨道;p电子的原子轨道呈________形,每个p能级有________个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是________电子,其电子云在空间有________方向;元素X的名称是_______,它的氢化物的电子式是____________。若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为________,原子的电子排布图为___________。
【答案】球 1 哑铃 3 2p 三个互相垂直的伸展 氮 ![]() S
S ![]()
【解析】
(1)s电子的原子轨道都是球形的,每个s能级有1个原子轨道;p电子的原子轨道都是哑铃形的,每个p能级有3个原子轨道,它们相互垂直,分别以px、py、pz表示。
(2)因为元素X的原子最外层电子排布式为nsnnn+1,np轨道已排上电子,说明ns轨道已排满电子,即n=2,则元素X的原子核外电子排布式为1s22s22p3,是氮元素,其中原子中能量最高的是2p电子,其电子云在空间有三个互相垂直的伸展方向;氮元素的氢化物是氨气,含有极性键,其电子式是![]() ;当元素X的原子最外层电子排布式为nsn-1npn+1时,根据上述分析,有n-1=2,则n=3,所以X元素的原子核外电子排布式为1s22s22p63s23p4,是硫元素;硫元素的元素符号为S,其原子的电子排布图为
;当元素X的原子最外层电子排布式为nsn-1npn+1时,根据上述分析,有n-1=2,则n=3,所以X元素的原子核外电子排布式为1s22s22p63s23p4,是硫元素;硫元素的元素符号为S,其原子的电子排布图为![]() 。
。

【题目】锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、MgO、Al2O3等杂质)是最重要的提锂矿石原料,工业上以α-锂辉石为原料制备碳酸锂,其工艺流程如图:

已知:①α-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应,α-锂辉石在高温下可转化为β-锂辉石,β-锂辉石具有更高的化学活性。
②β-锂辉石可与浓硫酸发生反应:2β-LiAl(SiO3)2+H2SO4(浓) ![]() Li2SO4+Al2O3·4SiO2·H2O。
Li2SO4+Al2O3·4SiO2·H2O。
③部分金属氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
请回答下列问题:
(1)将LiAl(SiO3)2改写成氧化物的形式为___,1000℃焙烧α-锂辉石的目的为___。
(2)滤渣2的主要成分为___,调节pH值的范围为___。
(3)“除大部分Mg”步骤的离子方程式为___。
(4)实验室蒸发浓缩操作中所需的仪器为酒精灯、铁架台(带铁圈)、___。
(5)洗涤过程中检验沉淀是否洗涤干净的操作为___。
(6)碳酸锂是制备锂离子电池的原料之一,某锂离子电池以CoP3作为负极材料,以LiMn1.5Ni0.5O4作为正极材料,以可传导放电Li+的无机固体电解质c-LATP作为电解液,其工作时电池反应为Li1-xMn1.5N0.5O4+Lix(CoP3)n![]() LiMn1.5Ni0.5O4+(CoP3)n,则该电池放电时负极的电极反应式为___,充电时阳极的电极反应式为___。
LiMn1.5Ni0.5O4+(CoP3)n,则该电池放电时负极的电极反应式为___,充电时阳极的电极反应式为___。