题目内容
【题目】锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、MgO、Al2O3等杂质)是最重要的提锂矿石原料,工业上以α-锂辉石为原料制备碳酸锂,其工艺流程如图:

已知:①α-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应,α-锂辉石在高温下可转化为β-锂辉石,β-锂辉石具有更高的化学活性。
②β-锂辉石可与浓硫酸发生反应:2β-LiAl(SiO3)2+H2SO4(浓) ![]() Li2SO4+Al2O3·4SiO2·H2O。
Li2SO4+Al2O3·4SiO2·H2O。
③部分金属氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
请回答下列问题:
(1)将LiAl(SiO3)2改写成氧化物的形式为___,1000℃焙烧α-锂辉石的目的为___。
(2)滤渣2的主要成分为___,调节pH值的范围为___。
(3)“除大部分Mg”步骤的离子方程式为___。
(4)实验室蒸发浓缩操作中所需的仪器为酒精灯、铁架台(带铁圈)、___。
(5)洗涤过程中检验沉淀是否洗涤干净的操作为___。
(6)碳酸锂是制备锂离子电池的原料之一,某锂离子电池以CoP3作为负极材料,以LiMn1.5Ni0.5O4作为正极材料,以可传导放电Li+的无机固体电解质c-LATP作为电解液,其工作时电池反应为Li1-xMn1.5N0.5O4+Lix(CoP3)n![]() LiMn1.5Ni0.5O4+(CoP3)n,则该电池放电时负极的电极反应式为___,充电时阳极的电极反应式为___。
LiMn1.5Ni0.5O4+(CoP3)n,则该电池放电时负极的电极反应式为___,充电时阳极的电极反应式为___。
【答案】Li2OAl2O34SiO2 将不和浓硫酸反应的α-锂辉石转化为和浓硫酸反应的β-锂辉石 Fe(OH)3、Al(OH)3和CaSO4 4.7≤pH<9.6 Ca(OH)2(s)+Mg2+(aq)=Mg(OH)2(s)+Ca2+(aq) 蒸发皿、玻璃棒 取少量最后一次的洗涤滤液于试管中,向其中滴加盐酸酸化的 BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净 Lix(CoP3)n-xe-=xLi++(CoP3)n LiMn1.5Ni0.5O4-xe-=Li1-xMn1.5Ni0.5O4+xLi+
【解析】
α-锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、MgO、Al2O3等杂质)高温焙烧转化成β-锂辉石,后加入98%浓硫酸低温焙烧,水浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Mg2+等杂质,得到的滤渣1为SiO2;加入石灰石调节pH,使Al3+、Fe3+转化为氢氧化物沉淀,同时生成微溶的硫酸钙,过滤,滤液中加入石灰乳除去大部分镁离子,生成滤渣3为氢氧化镁,滤液再加入碳酸钠调节pH至11-12,进一步除去钙、镁离子,滤渣4为碳酸钙、氢氧化镁等,滤液为硫酸锂溶液,蒸发浓缩后再加碳酸钠溶液得到碳酸锂沉淀,过滤洗涤干燥得到碳酸锂,以此解答该题。
(1)硅酸盐改写为氧化物的形式要注意活泼金属氧化物在前,其次为不活泼金属氧化物,再次为非金属氧化物,最后为水,中间用小圆点隔开,各元素的比例不能改变,故将LiAl(SiO3)2改写为氧化物的形式为Li2OAl2O34SiO2;根据题目信息可知α-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应, α-锂辉石在高温下可转化为β-锂辉石,β-锂辉石具有更高的化学活性,可与浓硫酸反应,故1000℃焙烧α-锂辉石的目的为将不和浓硫酸反应的α-锂辉石转化为和浓硫酸反应的β-锂辉石;
(2)加入碳酸钙调pH目的是将Fe3+和Al3+转化为Fe(OH)3和Al(OH)3,碳酸钙还可以和硫酸反应生成微溶的硫酸钙,所以滤渣2的主要成分为Fe(OH)3、Al(OH)3和CaSO4;根据表格可知将Fe3+和Al3+沉淀,而不使Mg2+沉淀,调节pH的范围为4.7≤pH<9.6;
(3)向溶液中加入石灰乳可将微溶的Ca(OH)2转化为难溶的Mg(OH)2,离子方程式为:Ca(OH)2(s)+Mg2+(aq)=Mg(OH)2(s)+Ca2+(aq);
(4)实验室蒸发操作除了使用酒精灯、铁架台(带铁圈)外,还需要蒸发皿和玻璃棒;
(5)沉淀的目的是洗去碳酸锂上吸附的溶液中的离子,溶液中的离子有硫酸根离子,可用检验硫酸根离子的方法检验,检验是否洗涤干净的方法是取少量最后一次的洗涤滤液于试管中,向其中滴加盐酸,再加入 BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
(6)该电池放电时负极失电子发生氧化反应,电极反应式为Lix(CoP3 )n-xe-=xLi++(CoP3)n,充电时阳极失电子发生氧化反应,电极反应式为LiMn1.5Ni0.5O4-xe-=Li1-x Mn1.5Ni0.5O4+xLi+。

 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】氯化亚铁常用于检测硒、污水处理等,其制备和元素含量测定方法有多种。 请回答下列问题:
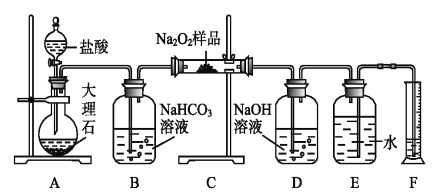
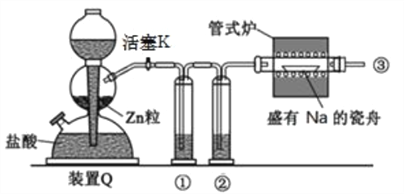
(1)方法一:用H2还原无水FeCl3制备, 已知FeCl2、 FeCl3易吸水。实验所需装置如下:
按气流从左到右的方向,装置的连接顺序为_________(仪器可重复使用)。
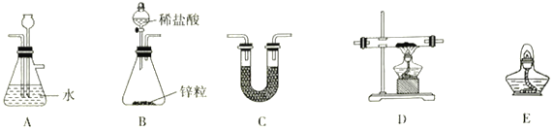
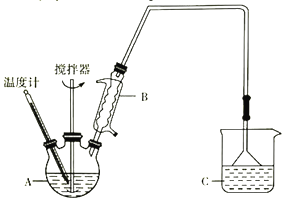
(2)方法二:用如图装置(夹持装置省略)制备氯化亚铁,发生反应2FeCl3+C6H6Cl→ 2FeCl2+C6H4Cl2+HCl。向A中加入无水氯化铁和氯苯,控制反应温度在一定范围加热一段时间。
相关物质的部分物理性质如表:
C6H5Cl(氯苯) | 对二氯苯 | 邻二氯苯 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | |||
熔点/℃ | -45 | 53 | -15 | — | — |
沸点/℃ | 132 | 173 | 180.5 | — | — |
①仪器B的名称是_________; 反应的温度最好控制在______左右:反应结束后,冷却实验装置,将仪器A内物质经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂是________。
②通过烧杯中的现象变化可监测反应的转化率,则烧杯C中所加试剂是_______。
③过滤液中含氯苯、邻二氯苯和对二氯苯,下列方法可用于鉴别氯苯和对二氯苯的是________。
a.质谱法 b.核磁共振氢谱法 c.元素分析法
(3)某同学用滴定法测定产品中铁元素含量,其测定过程如图:
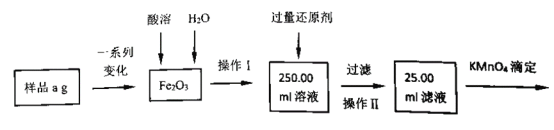
①该过程中酸溶时选择的最佳试剂是____;还原剂是_______。
②若滴定过程中消耗c mol·L-1KMnO4溶液VmL,则样品中铁元素的质量分数是_____。 (用含a、c、V的代数式表示)