题目内容
8.氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如图1.
按要求回答下列问题:
(1)操作①的名称是过滤,检验溶液2中是否含有杂质离子的试剂是KSCN溶液或苯酚.
(2)上述流程中,所得固体K需要加稀盐酸溶解,其理由是抑制氯化铜、氯化铁水解;
溶液1可加试剂X用于调节pH,以除去杂质,试剂 X和固体J分别是(填序号)c.
a.NaOH Fe(OH)3b.NH3•H2O Fe(OH)2c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;.
(4)如图2所示将氯气从a通入与粗铜反应(铁架台、铁夹、酒精灯省略),①反应时,盛粗铜粉的试管中的现象是产生大量棕黄色烟.
②反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效.该电化学腐蚀过程中的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.
分析 粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体;
(1)操作①是分离固体和液体混合物的操作;溶液2中若含有杂质离子则是Fe3+,用KSCN溶液检验;
(2)氯化铜、氯化铁在溶液中会发生水解,铜盐水解生成氢氧化铜,保持溶液呈强酸性,避免铜离子水解损失,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀;
(3)根据信息可知:SO2与铜离子反应生成CuCl白色沉淀和SO42-;
(4)①Cu与Cl2反应产生大量棕黄色烟(CuCl2);
②正极上ClO-得电子生成Cl-.
解答 解:粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体;
(1)操作①是分离固体和液体混合物的操作,所以操作①的名称是过滤,溶液2中若含有杂质离子则是Fe3+,用KSCN溶液或苯酚检验,
故答案为:过滤;KSCN溶液或苯酚;
(2)氯化铜、氯化铁中的金属离子易水解,直接用水溶液配制溶液会产生浑浊,所以加入过量的盐酸来溶解氯化铜、氯化铁,以抑制氯化铜、氯化铁水解;用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)或Cu2(OH)2CO3,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,且不能引入新杂质,
故答案为:抑制氯化铜、氯化铁水解;c;
(3)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
(4)①Cu与Cl2反应产生大量棕黄色烟(CuCl2),则反应时盛粗铜粉的试管中的现象是产生大量棕黄色烟;
故答案为:产生大量棕黄色烟;
②反应后,盛有NaOH溶液的广口瓶中生成NaClO溶液,该溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,ClO-得电子作正极生成Cl-,则正极上的电极方程式为:ClO-+2e-+H2O=Cl-+2OH-,
故答案为:ClO-+2e-+H2O=Cl-+2OH-.
点评 本题以实验室制备氯化铜为背景,考查了物质的制备实验操作、离子检验、除杂质、离子方程式的书写、原电池原理的应用等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 49.0g | B. | 73.5g | C. | 98.0g | D. | 147g |
| A. | Cl- | B. | Br- | C. | I- | D. | Cl2 |
| A. | 1:1 | B. | 1:2 | C. | 1:5 | D. | 2:3 |

已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑; ③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计或精密pH试纸(填写仪器或试剂名称).
(2)酸化步骤中用醋酸调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)如表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入过量二氧化碳(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{m}{n}$(用含m、n的代数式表示).
(5)用电解法除去含Cr2O72-的酸性废水方法是:用Fe做电极电解含Cr2O72-的酸性废水,随着解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.用Fe做电极的原因为(结合电极反应解释,下同)阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+,在阴极附近溶液pH升高的原因是2H++2e-=H2↑,氢离子放电使OH-浓度增大.
| A. | 铁钉放入硫酸铜溶液中,溶液由蓝色变为浅绿色 | |
| B. | 将空气中燃着的硫伸入氧气瓶中,火焰由黄色变为蓝紫色 | |
| C. | 高温加热木炭与氧化铜的混合物,固体由黑色变成红色 | |
| D. | 往水中加入少量高锰酸钾,液体由无色变成紫红色 |
| 物质 | C | H2 | CO |
| △H/kJ•mol-1 | -393.5 | -285.8 | -283.0 |
①写出C完全燃烧的热化学方程式C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol;
②相同条件下,相同体积的氢气与一氧化碳完全燃烧,放出热量较多的是H2;
③写出煤转化为水煤气的主要反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol.
 $→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O $\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O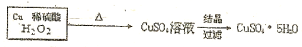 .
.