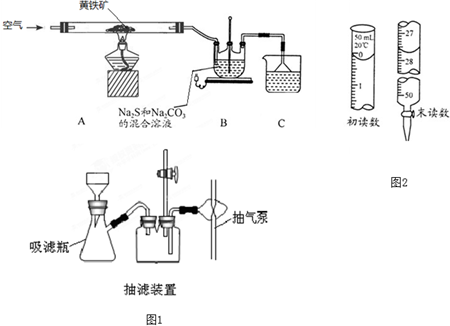
题目内容
13.CuSO4•5H2O是一种重要的化工原料.实验室以Cu为原料制取CuSO4•5H2O有如下方法:方法一:Cu$→_{高温灼烧}^{空气}$CuO$\stackrel{稀硫酸}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
(1)该方法中金属铜应在坩埚(填仪器名称)中灼烧.
方法二:空气→
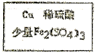 $→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O(2)该方法中少量Fe2(SO4)3起催化作用,其催化机理为(用离子方程式表示)
Cu+2Fe3+═2Fe2++Cu2+,4H++O2+4Fe2+═4Fe3++2H2O.调节溶液PH3~4,可使Fe3+完全转化为Fe(OH)3沉淀,调节时加入的试剂为CuO、CuCO3、Cu(OH)2.
方法三:
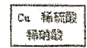 $\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O(3)①该方法中首先要将Cu与稀硫酸和稀硝酸混合.为了只得到CuSO4溶液,需向100mLl.0moI•L-1稀硝酸中加入150mL 1.0mol•L-1稀硫酸与之混合.
②Cu与稀硫酸和稀硝酸的反应装置如图甲所示:
实验室中对圆底烧瓶加热的最佳方式是水浴加热;
装置中圆底烧瓶上方长导管的作用是导气兼冷凝回流.
③下列可做为图乙中尾气收集或吸收装置的是AC(填字母).
(提示:2NO2+2NaOH═NaNO2+NaNO2+H2O,NO2+NO+2NaOH═2NaNO2+H2O)
(4)上述方法中,方法一耗能大,方法二步骤多,方法三生成有毒气体.请综合考虑有关设计因素设计一个实验室制备CuSO4•5H2O的方案流程图
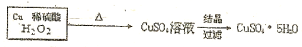 .
.供选择的试剂:Cu、Cl2、KMnO4、H2O2、浓硫酸、稀盐酸、稀硫酸等.

分析 (1)灼烧固体应在坩埚中进行,据此答题;
(2)亚铁离子能被空气中的氧气氧化成铁离子,调节pH值要能与酸反应且不引入新的杂质,同时不能使铜离子沉淀;
(3)①Cu与稀硫酸和稀硝酸混合,为了只得到CuSO4溶液,硝酸只能全部做氧化剂生成一氧化氮,根据电子得失守恒可计算硝酸的物质的量;
②根据反应的条件可判断加热方式,硝酸易挥发,所以要冷凝回流,同时导管能导气;
③NO难溶于水,可以用排水法收集,反应的尾气为NO,要与氧气反应后才能被氢氧化钠吸收,据此选择装置;
(4)根据题中提供的药品可知,实验室制备CuSO4•5H2O较好的方法是在硫酸溶液中用双氧水氧化铜,为保证反应速率可适当加热,得硫酸铜溶液后再通过蒸发浓缩、降温结晶、过滤得CuSO4•5H2O,据此答题.
解答 解:(1)灼烧固体应在坩埚中进行,
故答案为:坩埚;
(2)亚铁离子能被空气中的氧气氧化成铁离子,反应的离子方程式为4H++O2+4Fe2+═4Fe3++2H2O,调节pH值要能与酸反应且不引入新的杂质,同时不能使铜离子沉淀,所以加入的试剂为CuO、CuCO3、Cu(OH)2等,
故答案为:4H++O2+4Fe2+═4Fe3++2H2O;CuO、CuCO3、Cu(OH)2;
(3)①Cu与稀硫酸和稀硝酸混合,为了只得到CuSO4溶液,硝酸只能全部做氧化剂生成一氧化氮,根据电子得失守恒可知,1mol硝酸能氧化1.5mol铜,同时也消耗1.5mol硫酸,所以100mLl.0moI•L-1稀硝酸即含有0.1mol硝酸中加入1.0mol•L-1稀硫酸的体积为150mL,
故答案为:150;
②该反应的条件为40℃-50℃,所以可以用水浴加热的方式,硝酸易挥发,所以要用圆底烧瓶上方长导管冷凝回流,同时导管能导气,
故答案为:水浴加热;导气兼冷凝回流;
③NO难溶于水,可以用排水法收集,反应的尾气为NO,要与氧气反应后才能被氢氧化钠吸收,所以选择AC装置,
故答案为:AC;
(4)根据题中提供的药品可知,实验室制备CuSO4•5H2O较好的方法是在硫酸溶液中用双氧水氧化铜,为保证反应速率可适当加热,得硫酸铜溶液后再通过蒸发浓缩、降温结晶、过滤得CuSO4•5H2O,所以实验方案的流程图为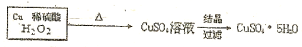 ,
,
故答案为: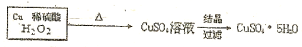 .
.
点评 本题以以Cu为原料制取CuSO4•5H2O为载体考查了实验基本操作、实验原理分析、实验方案的设计等,题目综合性强,难度中等,答题时注意元素化合物质的基础知识的灵活运用.

| A. | 磺化反应 | B. | 消去反应 | C. | 水解反应 | D. | 聚合反应 |

| A. | 图①是pH=13的NaOH溶液中加水稀释 | |
| B. | 图②是用适量的KClO3和MnO2混合物加热制O2 | |
| C. | 图③是向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量 | |
| D. | 图④向一定质量的稀盐酸中加入铁粉至过量 |
| 元素 | X | Y | Z | W | R |
| 相 关 信 息 | 能形成+7价的化合物 | 日常生活中常见的金属,熔化时并不滴落,好像有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子,它是空气的主要成分之一 | 焰色反应为黄色 | 位于第ⅣA族,是形成化合物种类最多的元素 |
(1)X在周期表中的位置是第三周期ⅦA族
(2)元素W的离子结构示意图为
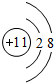
(3)元素R的最高价氧化物的电子式为
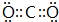
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型有离子键、共价键;将A溶于水,其水溶液中离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(5)含Y的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是(用离子方程式表示)Al3++3H2O=Al(OH)3(胶体)+3H+
(6)W2O2常用作舰艇、航天器的供氧剂,写出体现其反应原理的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
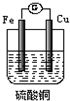
| A. | 装置中铜是负极 | |
| B. | 铜表面的反应为:2H++2e-=H2↑ | |
| C. | 电流的方向是从铁经导线流向铜 | |
| D. | 构成原电池后,铁与硫酸铜的反应速率加快 |