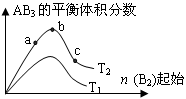
题目内容
一定温度下,在容积为2L的密闭容器中发生反应C0(g)+H20(g) C02(g)+H2(g),部分数据见下表(表中t2>t1):
C02(g)+H2(g),部分数据见下表(表中t2>t1):
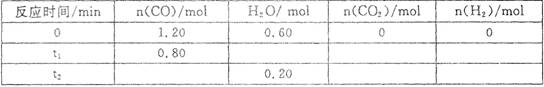
下列说法正确的是
 C02(g)+H2(g),部分数据见下表(表中t2>t1):
C02(g)+H2(g),部分数据见下表(表中t2>t1):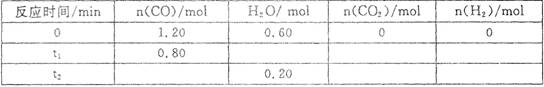
下列说法正确的是
A.反应在t1 min内的平均速率为 |
| B.平衡时CO的转化率为66.67% |
| C.该温度下反应的平衡常数为1 |
| D.其他条件不变,若起始时n(C0)="0.60" mol, n(H20)=" 1.20" mol,则平衡时n(C02)=" 0." 20 mol |
C
本题考查化学反应速率及化学平衡的有关计算。由反应方程式可知,氢气的平均反应速率等于CO的平衡反应速率,故有v(H2)=v(CO)=(1.2-0.8)/2t1,即,v(H2)=(0.2/t1)mol·L-1·min-1,故A不正确;根据表中数据可知,t2、t1时刻H2O的物质的量相等,说明在t1时刻已达平衡,则平衡时CO的转化率为0.4/1.2=33.3%,故B不正确;平衡常数为K=c(C02)×c(H2)/[c(C0)×c(H20)]=0.4×0.4/(0.8×0.2)=1,C正确;
C0(g) + H20(g)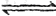 C02(g)+ H2(g)
C02(g)+ H2(g)
始量0.60 1.20 0 0
变量 x x x x
平衡0.60-x 1.20- x x x
则有x2/[(0.60-x)×(1.20- x)]=1,解得x=0.4,即n(C02)=" 0.40" mol,D不正确
C0(g) + H20(g)
 C02(g)+ H2(g)
C02(g)+ H2(g)始量0.60 1.20 0 0
变量 x x x x
平衡0.60-x 1.20- x x x
则有x2/[(0.60-x)×(1.20- x)]=1,解得x=0.4,即n(C02)=" 0.40" mol,D不正确

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
 2NH3。
2NH3。
 SO3(g)达到平衡,SO2的转化率前者大
SO3(g)达到平衡,SO2的转化率前者大 N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡时,与第一次平衡时相比,NO2的体积分数增大
N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡时,与第一次平衡时相比,NO2的体积分数增大 2Z(g)+2Q(s)
2Z(g)+2Q(s)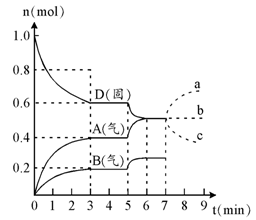
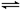 Ag2O(s)+SO3(g),2SO3(g)
Ag2O(s)+SO3(g),2SO3(g) 2Z(g)。反应达到平衡状态A时,测得气体总物质的量为6.6 mol。,回答下列问题:
2Z(g)。反应达到平衡状态A时,测得气体总物质的量为6.6 mol。,回答下列问题: 2AB3(g)化
2AB3(g)化