题目内容
【题目】某同学用下列所示实验装置制取乙酸乙酯.回答以下问题: 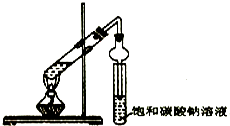
(1)在大试管中先加入3mL , 然后一边摇动一边慢慢地加入2mL和2mL乙酸,混合均匀,然后加入几粒碎瓷片.按上图连好装置,用酒精灯对大试管小心均匀加热.当观察到明显现象时停止实验.
(2)与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中.在此处球形干燥管的作用除了使乙酸乙醋充分冷凝外还有;
(3)有甲、乙、丙三位同学,分别将乙酸与乙醉反应得到的酯(未用饱和Na2CO3溶液承接)提纯,在未用指示剂的情况下,他们都是先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来.但他们的结果却不同: ①甲得到了不溶于水的中性酯;②乙得到显酸性的酯的混合物;③丙得到大量水溶性物质.
试判断三位同学加入的NaOH是多了还是怡好还是少了(填“少量”、“适量”、“过量“)
①②③
【答案】
(1)乙醇;浓H2SO4
(2)防倒吸
(3)适量;少量;过量
【解析】解:(1)乙醇、乙酸在浓硫酸做催化剂,吸水剂条件下加热反应生成乙酸乙酯,浓硫酸密度大,稀释时放出大量的热,所以应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;添加顺序依次乙醇、浓硫酸、乙酸;所以答案是:乙醇 浓H2SO4;(2)乙酸和乙醇易溶于水,不插入液面下是为了防止倒吸,球形干燥管导气的同时也起到防倒吸作用,
所以答案是:防倒吸;(3)①甲得到了不溶于水的中性酯,没有酸,说明所加NaOH溶液恰好中和了过量的酸,
所以答案是:适量;②乙得到显酸性的酯的混合物,酸有剩余,说明是所加NaOH溶液不足未将酸完全反应,
所以答案是:少量;③丙得到大量水溶性物质,说明没有酯,是因为所加NaOH溶液过量,酯发生水解,
所以答案是:过量.

【题目】教材中给出了Na2O2与水反应的化学方程式,某学习小组通过实验研究Na2O2与水发反应机理
操作 | 现象 |
Ⅰ.向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
Ⅱ.向溶液a中滴入两滴酚酞 | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
Ⅲ.向溶液中加入少量MnO2粉末 | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
(1)Na2O2的电子式为 , 很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表示反应的机理,写出Na218O2与H2O反应的化学方程式 .
(2)操作Ⅱ中红色褪去的可能原因是 .
(3)用反应2MnO4﹣+5H2O2+6H+=2Mn2++502↑+8H2O测定溶液a中H2O2含量.取20.00mL溶液a,用稀(填化学式)酸化,用0.002molL﹣1KMnO4溶液滴定,至终点时平均消耗10.00mLKMnO4溶液.滴定时KMnO4溶液应装在(填酸或碱)式滴定管中,终点确定的方法是 , 经计算溶液a中c(H2O2)=molL﹣1
(4)向溶液a中滴加FeSO4溶液,发生反应的离子方程式为 .
(5)向FeSO4溶液中加入一定量Na202固体,并以物质的量为2:1发生反应,反应中无气体生成,写出反应的离子方程式 .