题目内容
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图:

根据图示转化关系回答:
(1)写出下列物质的化学式:
A______________,B___________,乙__________,丁_________;
(2)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式____________________________________;
②甲与NaOH溶液反应的离子方程式____________________________________;
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子数目为________。
【答案】 Al O2 NaAlO2 Al(OH)3 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ Al2O3+2OH-===2AlO2-+H2O 0.1 mol 0.3NA
【解析】A是金属且能与NaOH溶液反应,所以A是Al,则C是H2,乙是NaAlO2,NaAlO2与过量的CO2反应生成的丁是Al(OH)3,由化合物甲与NaOH溶液反应可以生成NaAlO2可知甲为Al2O3,所以B为O2,丙为H2O。
(1)由上分析可知:A、B、乙、丁的化学式为:Al、O2、NaAlO2、Al(OH)3。
(2)①Al与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。②Al2O3与NaOH溶液反应的离子方程式为Al2O3+2OH-===2AlO2-+H2O。
(3)标准状况下体积为3.36 L的氢气的物质的量n(H2)=3.36L÷22.4L/mol=0.15mol,根据2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知n(Al)= 0.15mol×2/3=0.1mol,0.11molAl参加反应失去的电子数为0.3NA,所以反应中转移的电子数目为0.3NA。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝箔滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: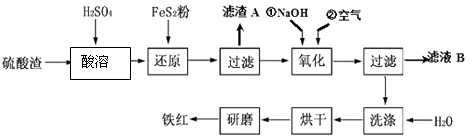
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为;“滤渣A”主要成份的化学式为 .
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+ , 而本身被氧化为H2SO4 , 请完成该反应的离子方程式:FeS2+14Fe3++H2O═15Fe2++SO ![]() + .
+ .
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 .
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) .
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |