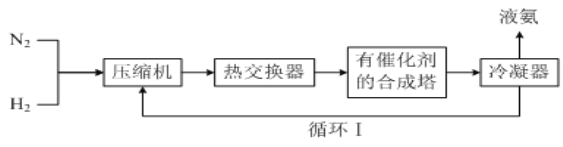
题目内容
【题目】高纯硝酸锶[Sr(NO3)2]可用于制作红色烟火、光学玻璃、电子管阴极材料等。由工业级硝酸锶(含有硝酸钡、硝酸钙等杂质)提取高纯硝酸锶的流程如下:

(1)滤液1中的主要溶质是___________(填化学式)。
(2)相对于水洗,滤渣1用浓硝酸洗涤的优点是________________________________。
(3)滤液2中过量的铬酸洗液被N2H4还原产生Cr3+和一种不污染环境的气体。该反应的离子方程式为______________________________________。
(4)滤渣3的主要成分是_____(填化学式);滤液3中c(Cr3+)=_____mol/L(常温下Ksp[Cr(OH)3]=6.3×10-31)。
(5)操作X为_____________;Sr(NO3)2·nH2O转化为高纯硝酸锶的过程温度要控制在100℃,目的是_________________。
(6)为测定Sr(NO3)2·nH2O的数值n,将7.44g Sr(NO3)2·nH2O晶体在100℃加热至恒重为6.36g的高纯硝酸锶。计算得n=______(M[Sr(NO3)2]=212g/mol)。
【答案】 Ca(NO3)2 HNO3 降低Sr(NO3)2(或硝酸盐)的溶解度,减少损失 2Cr2O72-+3N2H4+16H+==4Cr3++3N2↑+14H2O Cr(OH)3 6.3×10-13 蒸发浓缩、冷却结晶、过滤、洗涤或结晶、过滤、洗涤 防止Sr(NO3)2分解 2
【解析】试题分析:本题以硝酸锶的提纯为依托,主要考查方程式的书写、溶度积的计算、晶体的制备方法等基础知识,考查考生对工业流程的综合分析能力、运用化学知识解决实际问题的能力和计算能力。
(1)流程中Sr元素一直存在于被处理的物质中,且Ba元素在用过量的铬酸洗液处理时才生成钡的化合物沉淀,所以工业级Sr(NO3)2第一步用浓硝酸处理时,Ca(NO3)2溶解在浓硝酸中,而Sr(NO3)2和Ba(NO3)2则沉淀在浓硝酸中。答案:Ca(NO3)2、HNO3。(2)滤渣1需要洗涤的是固体表面浓硝酸中的Ca(NO3)2,而Sr(NO3)2和Ba(NO3)2易溶于水难溶于浓硝酸,因此水洗容易造成Sr(NO3)2的损失。正确答案:降低Sr(NO3)2溶解度,减少损失。(3)滤渣1经过浓硝酸洗涤除去残留中的Ca(NO3)2后,加水溶解后得到Sr(NO3)2、Ba(NO3)2的混合溶液(含有少量HNO3),再加过量铬酸洗液“沉钡”并分离后,滤液中主要含有Sr(NO3)2和过量的铬酸。因此,滤液2中过量的铬酸洗液被N2H4还原产生Cr3+和一种不污染环境的气体,这种气体是N2H4被Cr2O72-氧化生成的N2,由此得到该反应为:Cr2O72-+N2H4→Cr3++N2,注意到反应前溶液呈酸性,配平之后的反应为:2Cr2O72-+3N2H4+16H+=4Cr3++3N2↑+14H2O。正确答案:2Cr2O72-+3N2H4+16H+=4Cr3++3N2↑+14H2O。(4)调节溶液的pH后除去沉淀可以得到Sr(NO3)2,因此该过程中生成Cr(OH)3沉淀。![]() ,解得
,解得![]() 。正确答案:Cr(OH)3 、6.3x10-13。(5)得到的纯净的Sr(NO3)2溶液后,由该溶液制取硝酸锶晶体首先需要蒸发浓缩,但是为了防止硝酸锶水解,需要先加入浓硝酸,然后再冷却结晶、过滤、洗涤、干燥即可得到所需晶体。同时由于硝酸盐的不稳定性,加热过程中温度不宜过高,以防止硝酸锶分解。正确答案:蒸发浓缩、冷却结晶、过滤、洗涤;防止Sr(NO3)2分解。(6)Sr(NO3)2·nH2O
。正确答案:Cr(OH)3 、6.3x10-13。(5)得到的纯净的Sr(NO3)2溶液后,由该溶液制取硝酸锶晶体首先需要蒸发浓缩,但是为了防止硝酸锶水解,需要先加入浓硝酸,然后再冷却结晶、过滤、洗涤、干燥即可得到所需晶体。同时由于硝酸盐的不稳定性,加热过程中温度不宜过高,以防止硝酸锶分解。正确答案:蒸发浓缩、冷却结晶、过滤、洗涤;防止Sr(NO3)2分解。(6)Sr(NO3)2·nH2O![]() Sr(NO3)2+nH2O。既晶体的物质的量与无水硝酸锶的物质的量相等,所以
Sr(NO3)2+nH2O。既晶体的物质的量与无水硝酸锶的物质的量相等,所以![]() ,解得n=2。正确答案:2。
,解得n=2。正确答案:2。