题目内容
【题目】下列关于胶体的叙述不正确的是
A. 胶体分散质的微粒直径在10-9 —10-7m之间
B. 用平行光照射胶体时,能产生丁达尔现象
C. 明矾产生的氢氧化铝胶体能够吸附水中杂质,达到净水目的
D. Fe(OH)3胶体是纯净物,能全部透过滤纸
【答案】D
【解析】
A. 胶体分散质的微粒直径在10-9~10-7m之间,A正确;
B. 用平行光照射胶体时,能产生丁达尔现象,B正确;
C. 明矾产生的氢氧化铝胶体能够吸附水中杂质,从而达到净水目的,C正确;
D. Fe(OH)3胶体属于分散系,是混合物,能全部透过滤纸,D错误;
答案选D。

【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如图:
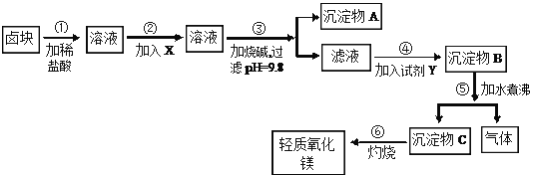
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH | 表2 化学试剂价格表 | ||||
物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
Fe(OH)3 | 2.7 | 3.7 | 漂液(含25.2% NaClO) | 450 | |
Fe(OH)2 | 7.6 | 9.6 | 双氧水(含30% H2O2) | 2400 | |
Mn(OH)2 | 8.3 | 9.8 | 烧碱(含98% NaOH) | 2100 | |
Mg(OH)2 | 10.0 | 11.1 | 纯碱(含99.5% Na2CO3) | 600 | |
(1)在步骤②中加入的试剂X(从表2中选择)是_______而不是双氧水,其原因是_______________________。写出加入X发生反应的离子方程式_______________________。
(2)在步骤③中控制pH=9.8,其目的是____________________________。
(3)沉淀物A的成分为______________,试剂Y(从表2中选择)应该是_______。
(4)在步骤⑤中发生反应的化学方程式是________________________。
(5)若在实验室中完成步骤⑥,则沉淀物C必需在_______(填仪器名称)中灼烧。
【题目】参考下列图表和有关要求回答问题:
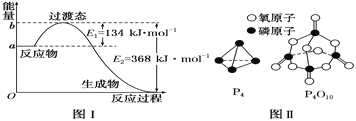
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O===O | P===O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1