题目内容
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是( )

A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
C. 每消耗1molX同时生成2mol Z,说明反应已达平衡
D. 反应开始到10s时,Y的转化率为79.0%
【答案】D
【解析】
A. 反应开始到10s生成Z是1.58mol,浓度是1.58mol÷2L=0.79mol/L,则用Z表示的反应速率为0.79mol/L÷10s=0.079mol/(L·s),A错误;
B. 根据图像可知X与Y是生成物,Z是反应物,平衡时消耗X是1.2mol-0.41mol=0.79mol,消耗Y是1.00mol-0.21mol=0.79mol,生成Z是1.58mol,根据变化量之比是化学计量数之比可知反应的化学方程式为X(g)+Y(g)![]() 2Z(g),B错误;
2Z(g),B错误;
C. 每消耗1molX同时生成2mol Z均表示正反应速率,不能说明反应已达平衡,C错误;
D. 反应开始到10s时,Y的转化率为0.79mol/1.00mol×100%=79.0%,D正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】由下表提供数据及相关物质结构知识,反应1:SiCl4(g)+2H2(g)=Si(g)+4HCl(g),反应2:Si(g)+O2(g)=SiO2(g),则反应1和反应2的反应热为
 硅的晶体结构
硅的晶体结构
化学键 | Si-Cl | H-H | Si-Si | H-Cl | O=O | Si-O |
键能kJ/mol) | 360 | 436 | 176 | 431 | 498 | 460 |
A. +236kJ/mol,-990kJ/mol B. -116kJ/mol,-990kJ/mol
C. -116kJ/mol,-70kJ/mol D. +236kJ/mol,-70kJ/mol
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)![]() 。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高温度,再次达到平衡时,v正 v逆可能落在A、B、C、D、E哪些点。
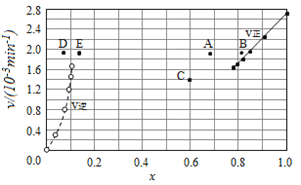
A. A D B. B D C. B E D. A E
