题目内容
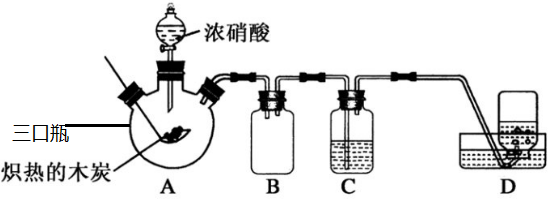
18. 如图,向碱式滴定管和烧杯中分别注入0.2mol•L-1Ba(OH)2溶液和0.1mol•L-1稀硫酸各50mL,并向稀硫酸中滴加几滴石蕊溶液,按如图装置连接好.
如图,向碱式滴定管和烧杯中分别注入0.2mol•L-1Ba(OH)2溶液和0.1mol•L-1稀硫酸各50mL,并向稀硫酸中滴加几滴石蕊溶液,按如图装置连接好.(1)按下开关接通电路,观察电流计指针偏转情况.
现象:电流计指针偏转.
结论:氢氧化钡、硫酸为电解质.
(2)挤压碱式滴定管胶管里的玻璃珠向烧杯中滴加Ba(OH)2溶液至过量,观察溶液中的现象和电流计指针的变化情况.
现象:电流计指针逐渐减小,为0,再偏转,生成白色沉淀.
结论:氢氧化钡和稀硫酸发生离子反应.
(3)思考以下几个问题:
①稀硫酸与Ba(OH)2溶液反应的实质是什么?Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O.
②该实验说明溶液的导电性与离子浓度有关.
③如果把硫酸溶液改为醋酸溶液,Ba(OH)2溶液改为氨水,仍按照上述操作进行实验,将看到的现象是:导电性逐渐增强.
分析 硫酸和氢氧化钡都为强电解质,溶液具有导电性,二者发生反应:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O;反应过程中,溶液中离子的浓度减小,其导电能力减弱,灯泡变暗,醋酸、一水合氨为弱电解质,二者生成醋酸铵,离子浓度增大,导电能力增强,以此来解答.
解答 解:(1)硫酸和氢氧化钡都为强电解质,溶液具有导电性,按下开关接通电路,电流计指针偏转,故答案为:电流计指针偏转;氢氧化钡、硫酸为电解质;
(2)挤压碱式滴定管胶管里的玻璃珠向烧杯中滴加Ba(OH)2溶液至过量,二者发生反应生成硫酸钡和水,离子浓度减小,导电性减小,Ba(OH)2溶液过量,指针偏转,
故答案为:电流计指针逐渐减小,为0,再偏转,生成白色沉淀;氢氧化钡和稀硫酸发生离子反应;
(3)①稀硫酸与Ba(OH)2溶液反应的实质是发生Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故答案为:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O;
②该实验说明溶液的导电性与离子浓度有关,故答案为:离子浓度;
③醋酸、一水合氨为弱电解质,二者生成醋酸铵,离子浓度增大,导电能力增强,故答案为:导电性逐渐增强.
点评 本题考查离子反应,为高考常见题型,明确发生的化学反应为解答的关键,把握反应的先后顺序及现象与导电性的关系,题目难度不大.

练习册系列答案
相关题目
9.下列对某些离子的检验实验,现象及结论一定正确的是( )
| 选项 | 实验方法 | 现象 | 结论 |
| 向某溶液加入AgNO3溶液 | 出现白色沉淀 | 原溶液中一定有Cl- | |
| 向某溶液加入BaCl2溶液 | 出现白色沉淀 | 原溶液中一定有SO42- | |
| 向某溶液加入NaOH溶液 | 出现蓝色沉淀 | 原溶液中一定有Cu2+ | |
| 向某溶液加入H2SO4溶液 | 产生无色无味气体 | 原溶液中一定有CO32- |
| A. | A | B. | B | C. | C | D. | D |
6.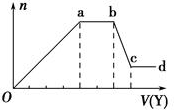 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系图所示.(提示:铵根和偏铝酸根不能共存)
(1)若Y是盐酸,则X溶液中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,ab段发生反应的总离子方程式为CO32-+2H+=H2O+CO2↑,图中Oa段与Y溶液反应的离子的物质的量之比为【要标明离子符号,如n(Na+)】.
(2)若Y是NaOH溶液,则ab段反应的离子方程式为NH4++OH-═NH3•H2O; bc段反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.若不考虑离子的水解因素,忽略H+和OH-,且溶液中只存在4种离子,则它们的离子个数比为【要标明离子符号,如n(Na+),按阳离子在前,阴离子在后,高价在前,低价在后得顺序排列】.
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则X溶液中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,ab段发生反应的总离子方程式为CO32-+2H+=H2O+CO2↑,图中Oa段与Y溶液反应的离子的物质的量之比为【要标明离子符号,如n(Na+)】.
(2)若Y是NaOH溶液,则ab段反应的离子方程式为NH4++OH-═NH3•H2O; bc段反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.若不考虑离子的水解因素,忽略H+和OH-,且溶液中只存在4种离子,则它们的离子个数比为【要标明离子符号,如n(Na+),按阳离子在前,阴离子在后,高价在前,低价在后得顺序排列】.
13.设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 常温下,22g CO2含有2NA个氧原子 | |
| B. | 标准状况下,22.4L的CCl4中含有的分子数为NA | |
| C. | 1mol/L的碳酸钠溶液中含Na+离子数为2NA | |
| D. | 常温下,将含0.1NA个HCl分子的氯化氢气体溶于水配成100mL溶液,所得溶液中C(H+)为1mol/L |
10.下列反应属于离子反应的是 ( )
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | ||
| C. | 2HCl+Zn═ZnCl2+H2↑ | D. | NaCl+AgNO3═AgCl↓+NaNO3 |
15.将a mol的NH3与b mol的O2混合后,充入一密闭容器,在Pt存在下升温至700℃,充分反应后,冷却至室温.
(1)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
(2)当a=2.00,b=4.00,在室温下得到的产物是什么?若该产物的密度为1.44g.ml-1,则其溶质的质量分数和物质的量浓度各是多少?
(1)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
| b∕a的取值范围 | 溶质 | 溶质物质的量 |