题目内容
【题目】如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。
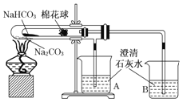
(1)点燃酒精灯加热,能观察到的实验现象是___________________________________。
(2)由上述实验你能得出的结论是_________________________________________。
(3)写出碳酸氢钠受热分解的化学方程式_________________________________________。
【答案】小试管中棉花球变蓝色,B烧杯中澄清石灰水变浑浊,A中有少量气泡冒出 碳酸氢钠受热易分解,有二氧化碳和水生成,碳酸钠受热不分解,无二氧化碳生成,由此可知,碳酸钠的热稳定性比碳酸氢钠强 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【解析】
因为NaHCO3的热稳定性不及Na2CO3的热稳定性,所以在加热时大试管中温度高的Na2CO3不分解,小试管中温度低的NaHCO3分解,分解产生的CO2能使B烧杯中的澄清石灰水变浑浊;分解产生的H2O能使棉花球变蓝。
(1)点燃酒精灯加热,大试管中温度高的Na2CO3不分解,小试管中温度低的NaHCO3分解生成碳酸钠、二氧化碳和水,沾有白色无水硫酸铜粉末的棉花球遇H2O生成五水合硫酸铜,使棉花球变蓝;B烧杯中澄清石灰水与二氧化碳反应变浑浊;大试管受热产生的气体不与澄清石灰水反应,可观察到有少量气泡冒出,故答案为:小试管中棉花球变蓝色,B烧杯中澄清石灰水变浑浊,A中有少量气泡冒出;
(2)小试管中为碳酸氢钠,说明温度低时可分解,而碳酸钠受热温度高,碳酸钠不分解,所以该实验说明碳酸氢钠受热易分解,有二氧化碳和水生成,碳酸钠受热不分解,无二氧化碳生成,由此可知,碳酸钠的热稳定性比碳酸氢钠强,故答案为:碳酸氢钠受热易分解,有二氧化碳和水生成,碳酸钠受热不分解,无二氧化碳生成,由此可知,碳酸钠的热稳定性比碳酸氢钠强;
(3)NaHCO3受热分解生成碳酸钠、二氧化碳和水,反应的化学方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑,故答案为:2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。

【题目】用NaOH标准溶液对某醋酸溶液的浓度进行标定。回答下列问题:
(1)实验用品有:0.2000 mol/L的NaOH溶液,醋酸溶液,蒸馏水;pH计,酸式滴定管,碱式滴定管,锥形瓶,烧杯,铁架台。还缺少的一种仪器是____________。
(2)为标定该醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_______________。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液

