题目内容
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1) A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的c (填 “变大”“变小”或“不变”)。
(填 “变大”“变小”或“不变”)。
(3)C中被腐蚀的金属是 ,总反应的化学方程式为
,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 (填序号)。
(12分,每空2分)(1)Fe + 2H+= Fe + H2↑
(2)2H+ + 2e-=H2↑ 变小 (3)Zn,Zn + H2SO4= ZnSO4 + H2↑;B > A >C
解析试题分析:(1)装置A中铁直接与稀硫酸发生置换反应,反应的离子方程式是Fe + 2H+= Fe + H2↑。
(2)装置B中铁的金属性强于Sn的,则铁是负极,Sn是正极,溶液中的氢离子在正极得到电子,电极反应式是2H+ + 2e-=H2↑,所以正极周围溶液中氢离子浓度变小。
(3)装置C中锌的金属性强于铁的,锌失去电子,做负极,被腐蚀。铁是正极,被保护,总的方程式是Zn + H2SO4= ZnSO4 + H2↑。根据以上分析可知,A、B、C中铁被腐蚀的速率,由快到慢的顺序为B>A>C。
考点:考查原电池的有关应用、金属的腐蚀与防护
点评:该题是基础性试题的考查,也是高考中的重要考点。主要是考查学生对原电池原理以及金属腐蚀与防护的熟悉了解程度,意在培养学生分析、归纳和总结问题的能力。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目








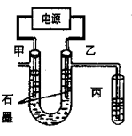
 CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: