题目内容
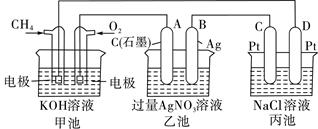
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答下列问题:
(1)把化学能转化为电能的装置是 (填“甲”或“乙”)。
(2)①若两池中均盛有CuSO4溶液,反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②乙池中碳极上电极反应式是 。
(3)若两池中均盛有饱和NaCl溶液,
①写出乙池中总反应的化学方程式为 ,
②若将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变 ,发生此现象的离子方程式为 ;若往乙池中滴入酚酞试液, (填铁或碳)棒附近呈现红色。
③若乙池中通过0.02mol 电子后停止实验,反应后池中溶液体积是200mL,溶液混匀后的c(OH-)为 。
(1)甲(2)①C Fe ②4OH--4e-=2H2O+O2↑(3)①2NaCl+2H2O Cl2↑+H2↑+2NaOH;②蓝 2Cl-+2H2O
Cl2↑+H2↑+2NaOH;②蓝 2Cl-+2H2O Cl2↑+H2↑+2OH- 铁 ③0.1mol/L
Cl2↑+H2↑+2OH- 铁 ③0.1mol/L
解析试题分析:(1)甲池为原电池,将化学能转化为电能;(2)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,外电路电子流向电源正极,所以碳棒为阳极,放出氯气,阴极铁电极上发生还原反应有Cu析出。②乙池中,惰性电极为阳极,电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH--4e-=2H2O+O2↑;(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,方程式为:2NaCl+2H2O Cl2↑+H2↑+2NaOH;②因为乙池附近有碘生成,故若将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2NaOH;②因为乙池附近有碘生成,故若将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,离子方程式为:2Cl-+2H2O Cl2↑+H2↑+2OH-;因为酚酞遇见变红,故往乙池中滴入酚酞试液,铁棒附近呈现红色;③电解氯化钠溶液的方程式为:2NaCl+2H2O
Cl2↑+H2↑+2OH-;因为酚酞遇见变红,故往乙池中滴入酚酞试液,铁棒附近呈现红色;③电解氯化钠溶液的方程式为:2NaCl+2H2O Cl2↑+H2↑+2NaOH,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=n/V=0.02mol/0.2L=0.1mol/L。
Cl2↑+H2↑+2NaOH,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=n/V=0.02mol/0.2L=0.1mol/L。
考点:原电池和电解池的工作原理 。

甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为______________________________________________________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
| A.c(H2)减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c(H2)/c(CH3OH)减小 |
(4)写出甲醇-空气-KOH溶液的燃料电池负极的电极反应式:__________________________________________________。

(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
①写出阳极电极反应式____________________________。
②写出除去甲醇的离子方程式__________________________________。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________(填字母)。
| A.铜 | B.钠 |
| C.锌 | D.石墨 |


 (1)工业上可利用反应Na(1)+ KCl(1) K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___ _____,
(1)工业上可利用反应Na(1)+ KCl(1) K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___ _____,


 (填 “变大”“变小”或“不变”)。
(填 “变大”“变小”或“不变”)。